Page 21 - 《华农农业大学学报》2020年第3期
P. 21
华 中 农 业 大 学 学 报 第 39 卷
6
1
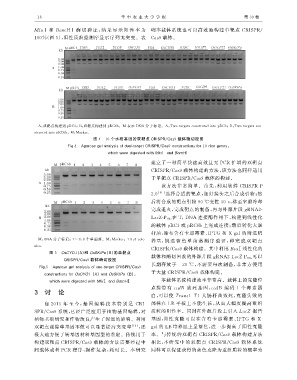
MluⅠ 和 BamHⅠ 酶 切 验 证, 结 果 显 示 阳 性 率 为 明本载体系统也可以高效地构建单靶点 CRISPR /
100% ( 图 5 ), 阳性质粒经测序显示序列无突变.表 Cas9 载体.
A : 双靶点构建到 p RC3 ; B : 双靶点构建到 p RC6b . M 表示 DNA 分子标记. A : Twotar g etsconstrutedintop RC3 ; B : Twotar g etsconG
structedintop RC6b ; M : Marker.
图 4 10 个水稻基因的双靶点 CRISPR / Cas9 载体酶切胶图
Fi g .4 A g aroseg elanal y sisofdualGtar g etCRISPR / Cas9constructionsfor10riceg enes ,
whichweredi g estedwithMluⅠ andBamHⅠ
建立了一种简单快速高效且无 PCR 扩增的双靶点
CRISPR / Cas9 载体构建的方法, 该方法也同样适用
于单靶点 CRISPR / Cas9 载体的构建.
该方法非常简单.首先, 利用软件 CRISPRGP
[ 21 ] 选择合适的靶点, 加好接头之后合成引物; 然
2.0
后将合成的靶点引物 90℃ 变性 30s , 移至室温冷却
完成退火, 完成靶点的制备, 再与外源片段 g RNA2G
LacZGP U6a 在 T 4 DNA 连接酶作用下, 构建到线性化
的载体 p RC3 或 p RC6b上完成连接; 最后转化大肠
杆菌, 涂布含有卡那霉素、 IPTG 和 XG g al的筛选培
M : DNA 分子标记; 1~8 : 8 个单菌 落. M : Marker ; 1G8 : 8coloG 养基, 挑 选 蓝 色 单 菌 落 测 序 验 证, 即 完 成 双 靶 点
nies.
CRISPR / Cas9 载体构建.其中利用 BsaⅠ 线性化的
图 5 OsCYO1 ( A ) 和 OsSKIPa ( B ) 的单靶点
载体和酶切回收的外源片段 g RNA2GLacZGP U6a 可以
CRISPR / Cas9 载体酶切胶图
长期存放于 -20℃ , 不需要每次制备, 非常方便用
Fi g .5 A g aroseg elanal y sisofoneGtar g etCRISPR / Cas9
constructionsforOsCYO1 ( A ) andOsSKIPa ( B ), 于大量 CRISPR / Cas9 载体构建.
本载体系统构建效率非常高.载体上的克隆位
whichweredi g estedwithMluⅠ andBamHⅠ
点携带 有 ccdB 致 死 基 因, ccdB 编 码 1 个 毒 素 蛋
3 讨 论
白, 可以使 Trans1GT1 大肠杆菌致死, 克隆失败的
菌株在 LB 平板上不能生长, 从而大幅度提高重组
自 2013 年 至 今, 基 因 编 辑 技 术 特 别 是 CRIG
SPR / Cas9 系统, 已经广泛应用于植物基因编辑, 对 质粒的阳性率.同时在外源片段上引入 LacZ 报告
植物基础研究和作物改良产生了深远的影响.利用 基因, 阳性克 隆可以 在 含 有 卡 那 霉 素、 IPTG 和 XG
双靶点敲除单基因不但可以显著提高突变率 [ 16 ] , 还 g al的 LB 培养皿上显蓝色, 进一步提高了阳性克隆
极大地方便了转基因材料基因型的鉴定.传统用于 率.与传统的双靶点 CRISPR / Cas9 载体构建方法
构建双靶点 CRISPR / Cas9 载体的方法需要经过中 相比, 本研 究 中 的 双 靶 点 CRISPR / Cas9 载 体 系 统
间载体或者 PCR 程序, 操作复杂, 耗时长.本研究 同样可以保证获得的蓝色克隆为重组质粒的概率为