人工授精(AI)是现代猪繁殖育种中不可或缺的重要一环,而精液质量直接决定AI的效果和猪场的效益[1];但由于猪精子膜结构的特殊性,使其抗冷应激的能力较差,因此生产中99%以上AI使用常温保存的猪精液,而稀释粉在精液的常温保存中扮演着非常重要的角色[2-3]。
稀释粉决定着精液稀释后的pH值、渗透压、营养物质等多种关乎精液质量的关键指标,是影响精液质量的一个重要外在因素[1,4]。而中效稀释粉以价格实惠、3~5 d适宜的保存时长,已然成为稀释粉中的主力,但我国稀释粉市场品牌纷杂,质量参差不齐,给养猪企业造成了很大的困扰[2]。因此,本研究从市场上选择了业内知名度较高的9种中效稀释粉进行常温保存对比试验,以期为养猪企业在选择稀释粉时提供参考,为我国制定稀释粉相关标准以及稀释粉进一步研发提供试验与理论依据。
1 材料与方法
1.1 试验精液和稀释粉
试验公猪精液来自湖北某公猪站,选择12头体型健壮、无生殖疾病史的杜洛克公猪,年龄在1~1.5岁,固定采精频率为每周1次。精液的采集和初检遵照GB/T 25172—2010和GB 23238—2009执行[5-6]。本试验所用的9种稀释粉由业内知名度较高的8个品牌组成,产品说明的有效保存时长均≥5 d,分别将其编号为稀释粉A、B、C、D、E、F、G、H、I。
1.2 溶液的配制
稀释粉的溶解按照各产品外包装的标识进行;低渗液由3.675 g的二水柠檬酸钠和6.750 g的果糖溶解至500 mL超纯水中配合而成(现配现用)。
1.3 精液的稀释和保存
首先依据国标《猪常温精液生产》 [5]中的要求推算稀释密度,结合原精量和测定密度确定稀释比。同时根据GB/T 25172—2010《猪常温精液生产与保存技术规范》[6]和NY/T 636—2002《猪人工授精技术规程》[7]的操作要求以精液与稀释液温差不超过1 ℃为标准进行稀释。稀释后待精液稳定0.5 h进行初检。最后,将稀释分装后的精液用毛巾包裹好,待其温度降至接近室温,再放入17 ℃恒温箱中,每隔12 h摇匀1次。
1.4 测定指标及方法
1) 酸碱度。每隔24 h取1.5 mL精液至10 mL离心管中,用pH计测定酸碱度的变化,每个样重复测定3次。
2)活力和有效保存时长。用HT CASAⅡ系统每24 h对精液进行1次活力检测,每个样品重复测定3次。
活力有效保存时长指稀释后的精液直线运动精子数占总精子的比例不低于60%的保存时长[2]。当活力连续2次检测均低于60%,即停止该稀释粉稀释精液所有指标的检测。
3)畸形率。根据前人研究结果和预试验的分析,发现精子畸形率等指标的变化慢于精子活力的变化,故本试验每隔48 h检测1次精子畸形率、顶体和质膜完整率的变化。
涂片后参照南京建成《精子快速染色液说明书》进行染色,用油镜放大1 000倍进行观察。每个样品制3张涂片,每张涂片至少计3个视野和200个以上的总精子,每张涂片的精子畸形率差异不超过20%,计算均值。
4)顶体完整率。由于顶体观察的前处理和畸形的处理相同,故顶体的观察和畸形同步进行,测定要求相同。
精子顶体完整率=所观察顶体完整的精子数/所观察的总精子数×100%
5)质膜完整率。质膜完整率采用低渗肿胀法(HOST)检测,先取适量低渗液和精液于37 ℃水浴10 min,然后按精液比低渗液为1∶10的比例混匀,于37 ℃孵育15 min,期间不时上下摇晃混匀。取10 μL在显微镜下放大300倍,计视野下的精子总数和弯尾数,每个样每次计200个以上总精子,根据以下公式计算弯尾率,即质膜完整率。每个样重复测定3次,3次间差异不超过20%,求均值。
精子质膜完整率=弯尾精子数/精子总数×100%
1.5 数据处理与统计分析
本试验数据采用Excel 2007进行汇总整理,利用SPSS 19.0进行单因素方差分析(One-way ANOVA),用Duncan’s多重比较分析差异显著性,最终以平均值±标准差![]() 形式展现。其中P<0.05表示差异显著。
形式展现。其中P<0.05表示差异显著。
2 结果与分析
2.1 不同稀释粉对精液pH值的影响
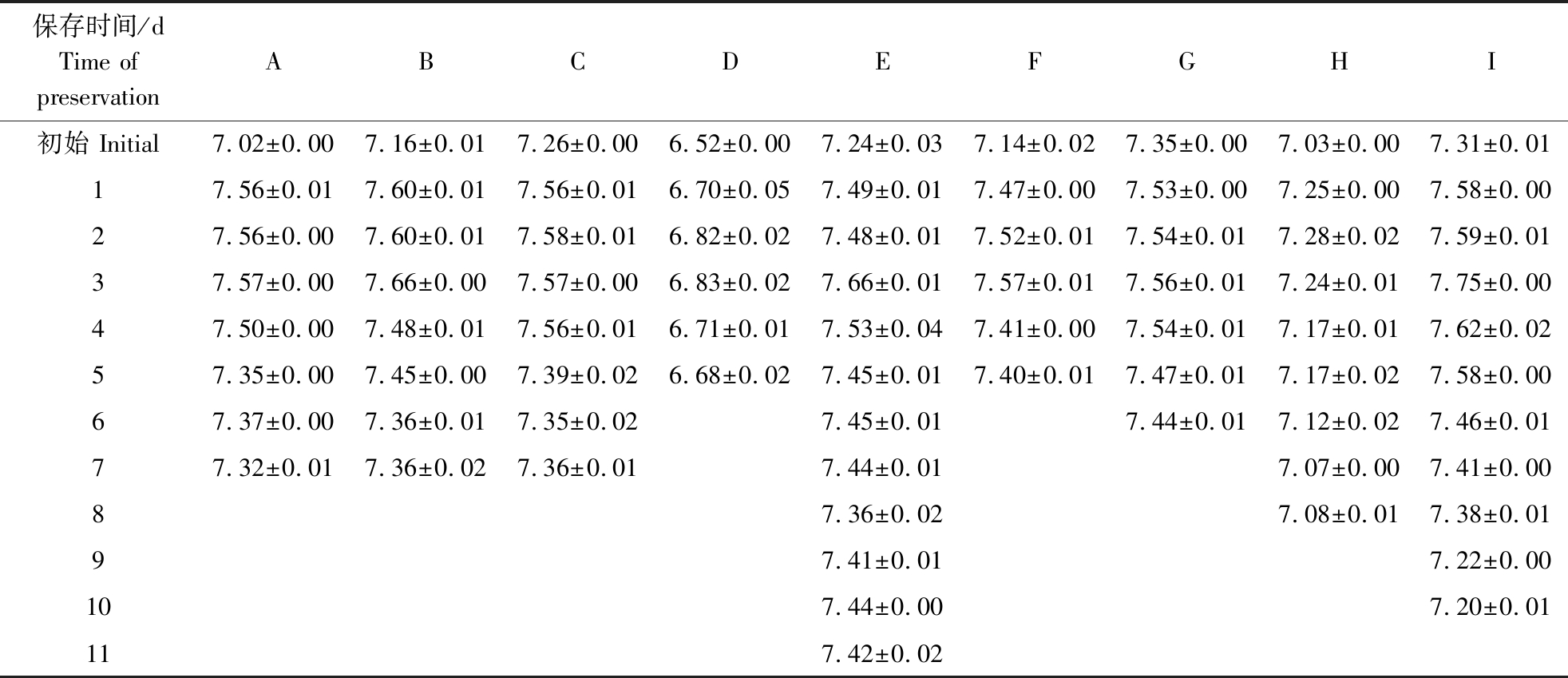
不同稀释粉稀释后,精液pH值随时间的变化情况见表1(由于试验各公猪原精的pH差异较大,且稀释后的变化规律相似,故此处仅列其中1头公猪精液的pH值变化情况,此公猪原精pH为7.29)。
表1 不同中效稀释粉稀释精液后pH值的变化
Table 1 Changes of pH value of semen diluted with different medium dilution powders
保存时间/d Time of preservationABCDEFGHI初始 Initial7.02±0.007.16±0.017.26±0.006.52±0.007.24±0.037.14±0.027.35±0.007.03±0.007.31±0.0117.56±0.017.60±0.017.56±0.016.70±0.057.49±0.017.47±0.007.53±0.007.25±0.007.58±0.0027.56±0.007.60±0.017.58±0.016.82±0.027.48±0.017.52±0.017.54±0.017.28±0.027.59±0.0137.57±0.007.66±0.007.57±0.006.83±0.027.66±0.017.57±0.017.56±0.017.24±0.017.75±0.0047.50±0.007.48±0.017.56±0.016.71±0.017.53±0.047.41±0.007.54±0.017.17±0.017.62±0.0257.35±0.007.45±0.007.39±0.026.68±0.027.45±0.017.40±0.017.47±0.017.17±0.027.58±0.0067.37±0.007.36±0.017.35±0.027.45±0.017.44±0.017.12±0.027.46±0.0177.32±0.017.36±0.027.36±0.017.44±0.017.07±0.007.41±0.0087.36±0.027.08±0.017.38±0.0197.41±0.017.22±0.00107.44±0.007.20±0.01117.42±0.02
各中效稀释粉所配稀释液的初始pH值中仅稀释粉D呈酸性,其余8种的初始pH值均在7.00~7.40。精液稀释后随着保存时间的延长,pH值整体呈先小幅上升后下降的趋势,其中稀释粉B和I的pH最大值与最小值相差最大,变化幅度最大,稀释粉D和G的变化幅度最小。
2.2 不同稀释粉对精子活力的影响
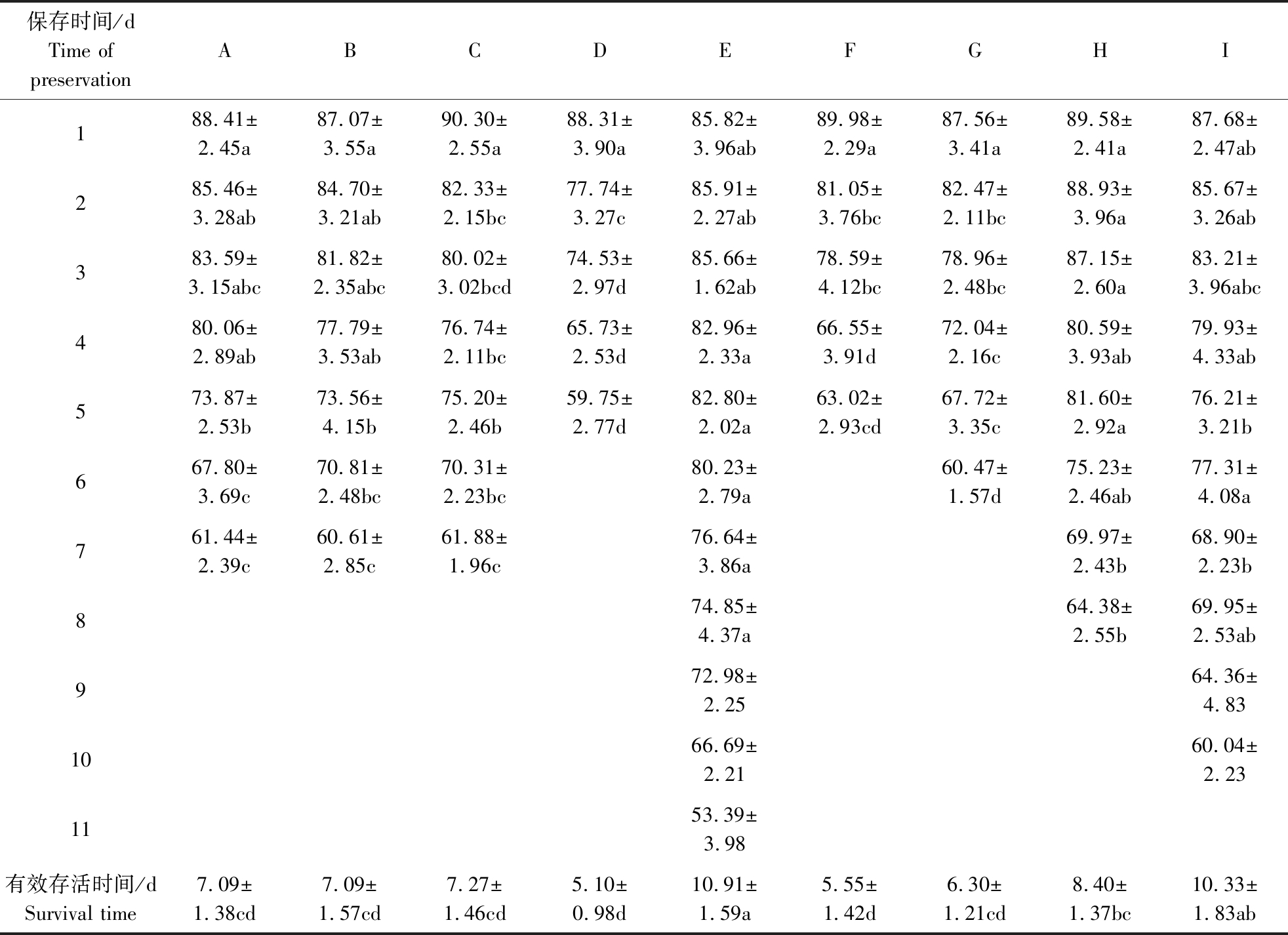
由表2不同稀释粉稀释的精液精子活力变化情况可知,保存的第1天各稀释粉组活力差异不显著(P>0.05),稀释粉E、H、I稀释的精液精子活力一直较高,其中稀释粉E的活力在保存3 d后显著高于稀释粉C、D、F、G(P<0.05);而稀释粉A、B、C间差异不显著(P>0.05),活力仅次于稀释粉E、H、I。稀释粉E和I的有效保存时长最长,达10.91 d和10.33 d,显著高于另外6种(P<0.05),其次为稀释粉H、C、B、A。稀释粉D、F的有效保存时长最短,仅5.10 d和5.55 d。
表2 不同中效稀释粉稀释的精液精子活力的比较
Table 2 Comparative analysis of the sperm motility in different medium term dilution powders %
保存时间/dTime ofpreservationABCDEFGHI188.41±2.45a87.07±3.55a90.30±2.55a88.31±3.90a85.82±3.96ab89.98±2.29a87.56±3.41a89.58±2.41a87.68±2.47ab285.46±3.28ab84.70±3.21ab82.33±2.15bc77.74±3.27c85.91±2.27ab81.05±3.76bc82.47±2.11bc88.93±3.96a85.67±3.26ab383.59±3.15abc81.82±2.35abc80.02±3.02bcd74.53±2.97d85.66±1.62ab78.59±4.12bc78.96±2.48bc87.15±2.60a83.21±3.96abc480.06±2.89ab77.79±3.53ab76.74±2.11bc65.73±2.53d82.96±2.33a66.55±3.91d72.04±2.16c80.59±3.93ab79.93±4.33ab573.87±2.53b73.56±4.15b75.20±2.46b59.75±2.77d82.80±2.02a63.02±2.93cd67.72±3.35c81.60±2.92a76.21±3.21b667.80±3.69c70.81±2.48bc70.31±2.23bc80.23±2.79a60.47±1.57d75.23±2.46ab77.31±4.08a761.44±2.39c60.61±2.85c61.88±1.96c76.64±3.86a69.97±2.43b68.90±2.23b874.85±4.37a64.38±2.55b69.95±2.53ab972.98±2.2564.36±4.831066.69±2.2160.04±2.231153.39±3.98有效存活时间/dSurvival time7.09±1.38cd7.09±1.57cd7.27±1.46cd5.10±0.98d10.91±1.59a5.55±1.42d6.30±1.21cd8.40±1.37bc10.33±1.83ab
注:同行中不同字母表示具有显著差异(P<0.05)。下同。Note:Distinct diffefences signified by different letters in the same row(P<0.05).The same as below.
2.3 不同稀释粉对精子畸形率的影响
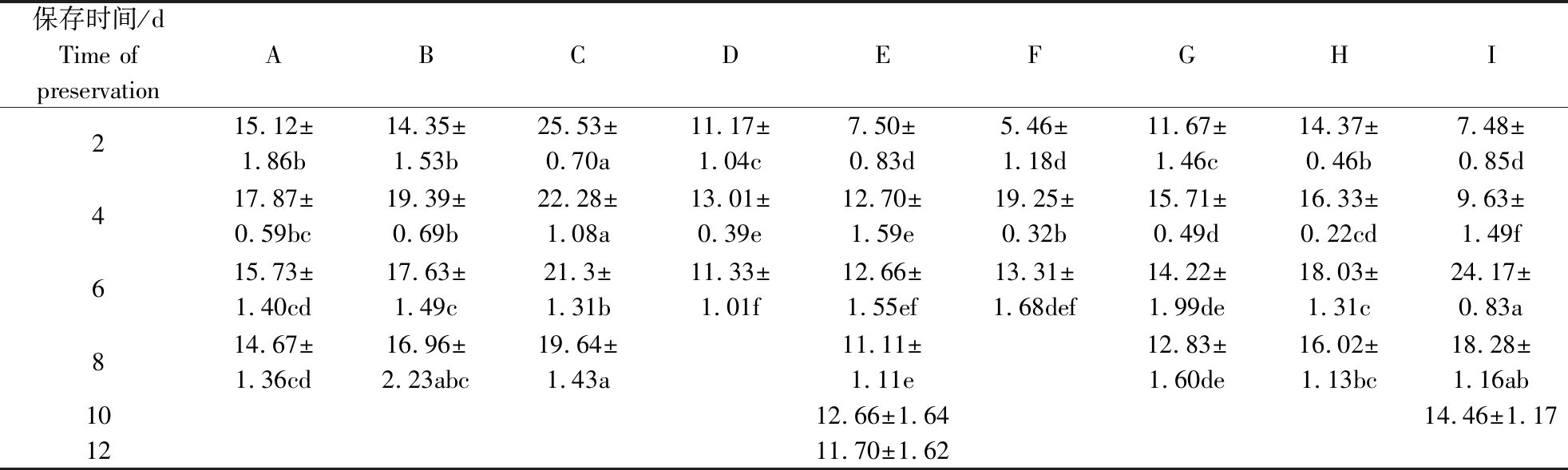
本试验稀释粉对精子畸形率的评定参照国标GB 23238—2009《猪常温精液生产》中的要求执行。根据表3中精子在不同中效稀释粉中的畸形表现可发现,在活力有效期内,畸形率整体呈先上升后下降的趋势。稀释粉C和I稀释的精液在活力有效期内畸形率超过20%,其中稀释粉C除第3天低于I外,其余时间一直显著高于另外8种(P<0.05);稀释粉B的畸形率仅次于C。而稀释粉D、E、G、H稀释的精液畸形率较低,其中稀释粉D、E显著低于另外4种(P<0.05)。图1所示为经巴氏染色后在油镜下观察到的正常形态精子和畸形精子。
表3 不同中效稀释粉稀释的精液精子畸形率
Table 3 Deformity rate of sperm in different medium term dilution powders %
保存时间/dTime ofpreservationABCDEFGHI215.12±1.86b14.35±1.53b25.53±0.70a11.17±1.04c7.50±0.83d5.46±1.18d11.67±1.46c14.37±0.46b7.48±0.85d417.87±0.59bc19.39±0.69b22.28±1.08a13.01±0.39e12.70±1.59e19.25±0.32b15.71±0.49d16.33±0.22cd9.63±1.49f615.73±1.40cd17.63±1.49c21.3±1.31b11.33±1.01f12.66±1.55ef13.31±1.68def14.22±1.99de18.03±1.31c24.17±0.83a814.67±1.36cd16.96±2.23abc19.64±1.43a11.11±1.11e12.83±1.60de16.02±1.13bc18.28±1.16ab1012.66±1.6414.46±1.171211.70±1.62
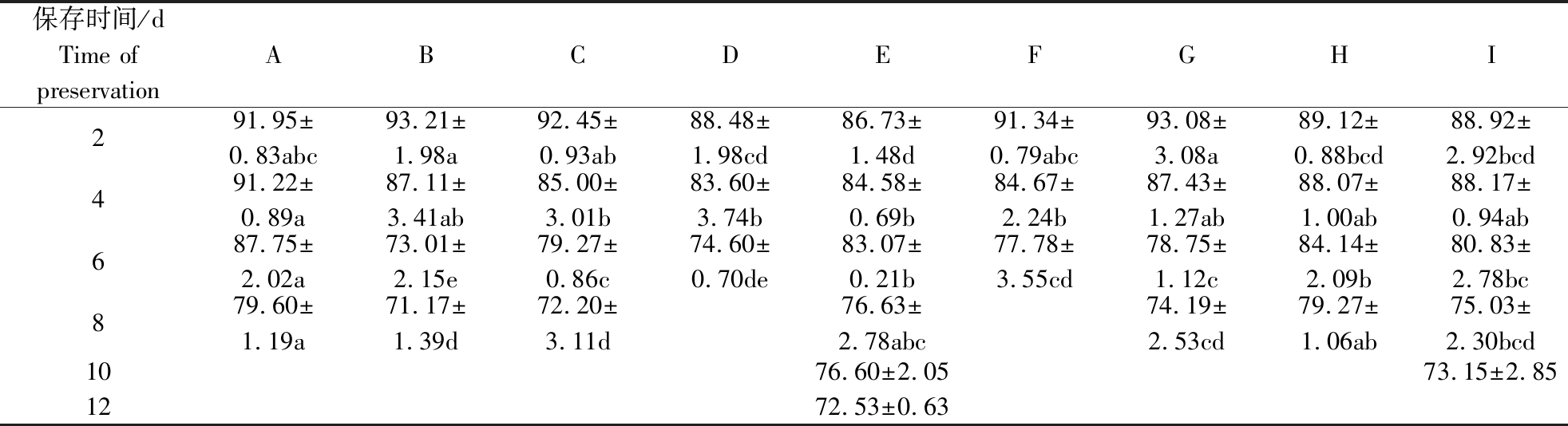
2.4 不同稀释粉对精子顶体完整率的影响
由表4可看出,顶体的完整率在某个时点呈迅速下降,如稀释粉B、D、G、I在保存4~6 d时顶体完整率出现近10%的降幅。在活力有效期内,稀释粉C、F、G的顶体完整率差异不显著(P>0.05)。稀释粉A除第2天外,顶体完整率一直最高,显著高于稀释粉C、D、F(P<0.05)。
表4 不同中效稀释粉稀释的精液精子顶体完整率
Table 4 Acrosome integrity rate of sperm in different medium term dilution powders %
保存时间/d Time ofpreservationABCDEFGHI291.95±0.83abc93.21±1.98a92.45±0.93ab88.48±1.98cd86.73±1.48d91.34±0.79abc93.08±3.08a89.12±0.88bcd88.92±2.92bcd491.22±0.89a87.11±3.41ab85.00±3.01b83.60±3.74b84.58±0.69b84.67±2.24b87.43±1.27ab88.07±1.00ab88.17±0.94ab687.75±2.02a73.01±2.15e79.27±0.86c74.60±0.70de83.07±0.21b77.78±3.55cd78.75±1.12c84.14±2.09b80.83±2.78bc879.60±1.19a71.17±1.39d72.20±3.11d76.63±2.78abc74.19±2.53cd79.27±1.06ab75.03±2.30bcd1076.60±2.0573.15±2.851272.53±0.63
图2所示为挑选的经巴氏染色后在油镜下观察到的顶体完整和异常情况。

a:正常; b:梨形头; c:尾部折断; d:尾部卷曲; e:断头; f:颈部弯曲。 a:Normal; b:Pear-shaped head; c:Broken tail; d:Curled tail; e:Curled head; f:Neck bend.
图1 巴氏染色后在油镜下观察到的正常和畸形精子
Fig.1 Normal and deformed sperm observed under the oil microscope after pap staining
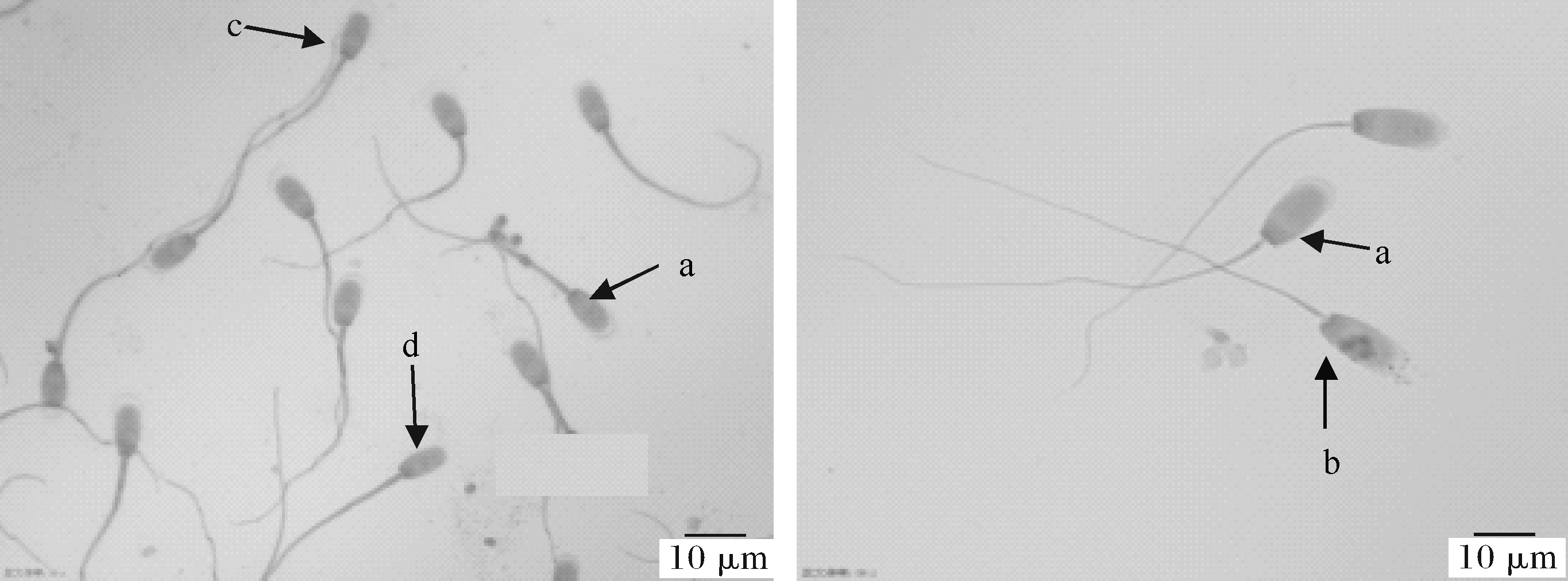
a:正常; b:顶体破损; c:顶体膨胀; d:顶体全脱。 a:Normal; b:Acrosome damage; c:Acrosome expansion; d:Acrosome abscission.
图2 巴氏染色后在油镜下观察到的精子顶体
Fig.2 Acrosomes of sperm observed under oil microscope after pap staining
2.5 不同稀释粉对精子质膜完整率的影响
质膜完整率在活力有效期内的变化见表5。其中6种稀释粉稀释的精液在保存4~6 d时,精子质膜完整率出现集中快速下降,下降幅度超10%。在试验2~12 d时,稀释粉E、H的质膜完整率较高,其中稀释粉H显著高于稀释粉D、F(P<0.05);稀释粉B、D、F、G的质膜完整率较低,其中稀释粉D的质膜完整率显著低于其余8种(P<0.05)。图3所示为经低渗液处理后的精子弯尾情况,其中尾部发生弯曲即代表质膜正常,否则为质膜破损。
表5 不同中效稀释粉稀释的精液精子质膜完整率
Table 5 Comparative analysis of the integrity rate of sperm in different medium term dilution powders %

保存时间/dTime ofpreservationABCDEFGHI278.44±0.79c77.67±1.11c83.82±3.91a66.05±0.92e82.56±2.13ab69.78±0.67d79.69±0.86bc81.56±1.23ab82.41±1.28abc467.51±3.06d71.08±2.25c74.60±1.47ab48.54±0.76e71.75±1.19bc67.19±1.66d67.63±1.20d77.18±1.65a72.26±1.65bc667.34±3.73a60.43±0.77cd59.67±1.46cd40.27±0.96f64.51±1.08ab48.68±1.46e51.32±1.81e57.42±0.78d62.67±1.12bc854.00±3.43c58.18±0.26b53.59±0.64c62.30±1.18a44.73±1.38d60.83±3.09ab54.59±1.25c1057.54±0.7955.65±2.071249.98±0.48

a:发生弯尾,质膜正常; b:尾部笔直,质膜破损。 a:The sperm plasma membrane is normal and the tail is curved; b:The sperm plasma membrane is damaged,the tail is straight.
图3 低渗液处理后精子的弯尾情况
Fig.3 The curved tail of spermatozoa treatedwith hypotonic solution
3 讨 论
3.1 9种稀释粉的合格率及影响因素
根据国标GB 23238—2009《猪常温精液生产》中对精液型式检验合格的要求[5],本试验所用的9种稀释粉稀释的精液在72 h内,外观均呈乳白色,无杂质、精子活力和每剂量直线运动精子数均达国家相应标准,而畸形率中除稀释粉C稀释的精液超20%外,其余8种均符合要求,故9种中效稀释粉达国标要求率为88.89%。9种稀释粉产品说明中标注的有效保存时长均≥5 d,本试验结果表明除稀释粉C外,其余稀释粉在5 d内精液外观、活力、每剂量直线运动精子数和畸形率均符合国家标准,达产品说明的合格率为88.89%。
本试验所选的9种不同稀释粉稀释的精液活力表现差异较大,与洪洁赟等[8]、贾玉川等[9]、戈新等[10]通过多种稀释粉稀释精液的检测结果趋势一致。稀释粉组分复杂,各组分的含量是影响精子活力的关键因素。有研究表明精液中的环磷酸腺苷水平可影响精子鞭毛拍打频率及鞭毛运动的不对称性,进而影响精液活力[11-12];而精子细胞中的Ca2+浓度在10~40 nmol/L时,精子的鞭毛呈对称式鞭打,但当其上升至100~300 nmol/L时其波形就会变得不对称,当Ca2+浓度过高时精子的运动也会受到抑制[13-14];同时![]() 通过影响Ca2+浓度也会影响精子鞭毛运动的对称性[15];此外高浓度的活性氧自由基 ROS同样会损伤精子的运动功能[16-17]。可见,常温保存精液的直线运动精子数受稀释粉组分和含量的直接影响。
通过影响Ca2+浓度也会影响精子鞭毛运动的对称性[15];此外高浓度的活性氧自由基 ROS同样会损伤精子的运动功能[16-17]。可见,常温保存精液的直线运动精子数受稀释粉组分和含量的直接影响。
本试验发现在国家标准对合格常温精液的相应要求中,精子畸形率为最大制约因素。本试验中除稀释粉C外,稀释粉B、F、I的畸形率也接近20%。试验精子畸形率偏高,可能主要有两方面的原因。其一,稀释粉的组成成分及含量可能存在问题。稀释粉中可致精子畸形的成分很多, Pipan等[18]的研究表明,精液中Se的水平与精子的形态呈显著相关。此外,高浓度的过氧化氢(H2O2)、一氧化氮(NO)和超氧化物阴离子![]() 以及过高或过低的渗透压[20]均会对精子形态造成影响,引起精子畸形。其二,公猪自身的原因。公猪的饲养管理和遗传因素都有可能致使精子畸形率偏高。但本试验中稀释粉D、E、G的畸形率始终在16%以下,可见本试验精子畸形率受公猪自身因素的影响较小,主要与稀释粉的组分有关。此外,有研究证实精液中添加抗生素和鱼精蛋白[21],可以有效降低畸形率。
以及过高或过低的渗透压[20]均会对精子形态造成影响,引起精子畸形。其二,公猪自身的原因。公猪的饲养管理和遗传因素都有可能致使精子畸形率偏高。但本试验中稀释粉D、E、G的畸形率始终在16%以下,可见本试验精子畸形率受公猪自身因素的影响较小,主要与稀释粉的组分有关。此外,有研究证实精液中添加抗生素和鱼精蛋白[21],可以有效降低畸形率。
3.2 不同稀释粉对各指标测定结果的影响
戈新等[10]认为,精液代谢过程中产生的乳酸等物质会使精液的pH值降低,对精子的长期保存不利,所以应使用碱性稀释液。但有研究表明精液在附睾中位于酸性环境,使其处于休眠状态;当射精排出体外和副性腺分泌的碱性物质混合而复苏变得活跃[22-24]。何兰花等[25]研究认为精液储存的最适pH值应为6.40;邢月超等[26]研究发现精液保存的最佳pH为6.40~6.50。可见,研究者们对猪精液稀释液的适宜pH值并没有统一的看法。虽然本试验用的9种稀释粉中有88.89%呈碱性,但酸碱性稀释粉的综合表现却各有优劣,未能证明偏酸或偏碱综合测定效果更好;综合前人研究结论和本研究结果可得出,猪精液对稀释液的pH值可能是有一定耐受性的,只要在适合的相对较大的耐受区间内即可,而非固定的某一个值或一个较小的pH范围。
本试验各稀释粉稀释精液后pH值变动幅度有一定差异,可能是由于稀释粉D、F、G、H中的缓冲物质对稳定pH的效果较好,而稀释粉A、B、I略差造成的。对于稀释保存期间pH值的波动范围,本试验结果表明效果较好的稀释粉C、D、G,pH值的波动范围均较小。与邢月超等[26]发现精液在稀释后pH值保持稳定有利于精液的长期保存的研究结论相吻合。同时,本试验发现9种稀释粉稀释精液后pH值整体呈先缓慢上升后下降,这和侯丽鹏等[27]测定的3种稀释液对精液pH值的变化结果相近。推测可能是由于精液被稀释后,代谢产生的酸性物质被稀释液中的缓冲物质中和,但由于缓冲物质被激活后无法立刻失活而导致pH值缓慢上升,随着保存时间的延长,缓冲物质被完全中和,pH值随即下降。而当使用的缓冲物缓冲效果较好或足量时,其pH值的下降和波动会相应减小。
顶体和质膜的完整率在我国现有相关标准中均未提及,但其在评判精液质量中的作用却极为重要。顶体内包含多种受精所需的酶类,包括对顶体反应、透明带反应等起关键作用的酶类,是判断精子是否具有受精能力的重要指标[28]。质膜是保护精子的重要屏障,若受损则精子内物质发生外流,会致精子死亡,故其与精子代谢、获能、存活时长等直接相关[29],二者对评定精液质量均具有重要意义。
本试验结果表明,9种稀释粉稀释的精液顶体和质膜完整率均存在较大差异,对应活力和畸形率的变化可发现,顶体和质膜完整率较高的稀释粉稀释的精液精子活力和畸形率指标也较好;同时顶体的变化晚于活力的变化,而质膜的变化早于活力的变化,这与耿果霞等[30]对精液质膜完整率和活力变化的测定结果相同,与洪洁赟等[8]采用4种不同稀释粉对稀释精液的顶体完整率和活力变化研究结果相近。顶体位于精子头部,较易受损;质膜覆盖于精子体表,是精子的“盾”,被认为是精子储存过程中最易受损的部分[24]。侯丽鹏[29]研究发现精子代谢产生的酸性物质会对精子的顶体和质膜造成损伤,若稀释液不能及时中和酸性物质,就会对精液质量造成极大破坏。而相关研究证实添加β-环糊精[31]、路易波士的提取物[32]、曲酸和双乙酸钠[33]等均可以起到保护顶体和膜结构完整性的效果。所以精子顶体和质膜保存效果较好的稀释粉中可能添加了起到特殊保护作用的物质,保存效果较差的稀释粉可能因为中和代谢酸的物质不足或效果较差。而精子的顶体和质膜在保存期的某个时段快速下降,推测可能由于部分保护剂含量和效果有限,或ROS积累到一定浓度,从而对精子质膜和顶体产生了集中性破坏造成的。
3.3 各稀释粉的综合选择建议
在许多猪场技术员和配种员观念中,常温保存的猪精液有效期只有3~5 d。而本试验中的中效稀释粉E、H有效保存时长均超过10 d,且各测定指标表现均较好。通过对一种稀释粉稀释精液质量的长期测定,其最适输精时段可以得到准确把握,配种员应摒弃对猪常温精液的传统认识,这将有利于猪场效益的稳定和提升。
本试验的结果表明,所选9种中效稀释粉的综合合格率达88.89%,但企业在选择稀释粉时仍应持谨慎态度。本试验通过测定9种中效稀释粉对猪精液常温保存期间pH值、活力、畸形率以及顶体和质膜完整率的变化,发现部分稀释粉的效果不容乐观。若有条件,企业可定期对稀释粉稀释精液后的多项指标变化情况进行综合测定,特别是精子畸形率和质膜完整率。通过对稀释粉稀释精液常温保存整体效果的评测,选择最适稀释粉,避免单一指标评估降低准确性,可以有效提升猪常温精液质量,从而更好地提升猪场的效率和效益。
[1] 李亚新,魏海燕,李思慧,等.猪人工授精技术发展趋势分析[J].畜牧兽医杂志,2015,34(3):42-44.LI Y X,WEI H Y,LI S H,et al.The development trend of swine artificial insemination technology[J].Journal of animal science and veterinary medicine,2015,34(3):42-44(in Chinese with English abstract).
[2] 刘兆军,谢景兴,魏宁,等.稀释剂添加物在猪精液常温保存中的研究进展[J].畜牧兽医杂志,2016,35(6):67-69.LIU Z J,XIE J X,WEI N,et al.Advances in different extender additives in boar semen stored at room temperature[J].Journal of animal science and veterinary medicine,2016,35(6):67-69(in Chinese with English abstract).
[3] 刘兆军,谢景兴,侯震坤,等.3种商品稀释剂对关中黑猪精液常温保存效果的研究[J].养猪,2016(4):33-36.LIU Z J,XIE J X,HOU Z K,et al.The effect of Guanzhong black pig’s semen stored at room temperature in three commercial extenders[J].Swine production,2016(4):33-36(in Chinese with English abstract).
[4] 王均亮,陶剑,张洁,等.不同稀释粉对公猪精液常温保存效果的影响[J].当代畜牧,2015(24):42-46.WANG J L,TAO J,ZHANG J,et al.Effects of different extenders on boar semen preservation in normal temperature[J].Contemporary animal husbandry,2015(24):42-46(in Chinese with English abstract).
[5] 全国畜牧总站,北京市畜牧兽医总站,农业部种猪质量监督检验测试中心(广州),等.猪常温精液生产:GB 23238-2009[S].北京:中国标准出版社,2009.National Animal Husbandry General Station,Beijing Animal Husbandry and Veterinary General Station,Breeding Pig Quality Supervision and Testing Center of the Ministry of Agriculture (Guangzhou),et al.GB 23238-2009,normal temperature semen production of pigs[S].Beijing:Standards Press of China,2009(in Chinese).
[6] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.中华人民共和国推荐性国家标准:猪常温精液生产与保存技术规范:GB/T 25172—2010[S].北京:中国标准出版社,2011.General Administration of Quality Supervision,Inspection and Quarantine of the People’s Republic of China,Standardization Administration of the People’s Republic of China.National Standard (Recommended) of the People’s Republic of China:technical specification for production and preservation of fresh boar semen:GB/T 25172—2010[S].Beijing:Standards Press of China,2011(in Chinese).
[7] 中华人民共和国农业农村部.中华人民共和国农业行业标准:猪人工授精技术规程:NY/T 636—2002[S].北京:中国标准出版社,2004.Ministry of Agriculture of the People’s Republic of China.Agriculture Standard of the People’s Republic of China:Rules for swine artificial insemination techniques:NY/T 636—2002[S].Beijing:Standards Press of China,2004(in Chinese).
[8] 洪洁赟,刘玉,莫金鑫,等.不同稀释液对猪精液常温保存效果的影响[J].西北农业学报,2012,21(9):10-14.HONG J Y,LIU Y,MO J X,et al.Effects of different diluents on quality of boar semen stored at normal temperature[J].Acta agriculturae boreali-occidentalis sinica,2012,21(9):10-14(in Chinese with English abstract).
[9] 贾玉川,黄大鹏.不同稀释粉对猪精液保存效果的影响[J].黑龙江八一农垦大学学报,2018,30(5):53-56.JIA Y C,HUANG D P.Effects of different diluent powder on the preservation of pig semen[J].Journal of Heilongjiang Bayi Agricultural University,2018,30(5):53-56(in Chinese with English abstract).
[10] 戈新,张宝珣,王建华,等.商品稀释剂pH值、渗透压测定及其对猪常温精液保存效果的比较[J].畜牧与兽医,2011,43(2):37-40.GE X,ZHANG B X,WANG J H,et al.The measurement of pH value and osmotic pressure of commercial diluents and the comparison of its effect on pig semen preservation at normal temperature[J].Animal husbandry & veterinary medicine, 2011,43(2):37-40(in Chinese).
[11] HESS K C,JONES B H,MARQUEZ B,et al.The “soluble” adenylyl cyclase in sperm mediates multiple signaling events required for fertilization[J].Developmental cell,2005,9(2):249-259.
[12] XIE F,GARCIA M A,CARLSON A E,et al.Soluble adenylyl cyclase (sAC) is indispensable for sperm function and fertilization[J].Developmental biology,2006,296(2):353-362.
[13] SUAREZ S S.Control of hyperactivation in sperm[J].Human reproduction update,2008,14(6):647-657.
[14] SUAREZ S S,VAROSI S M,DAI X.Intracellular calcium increases with hyperactivation in intact,moving hamster sperm and oscillates with the flagellar beat cycle[J].PNAS,1993,90(10):4660-4664.
[15] WENNEMUTH G,CARLSON A E,HARPER A J,et al.Bicarbonate actions on flagellar and Ca2+-channel responses:initial events in sperm activation[J].Development (Cambridge,England),2003,130(7):1317-1326.
[16] DU PLESSIS S S,MCALLISTER D A,LUU A,et al.Effects of H2O2 exposure on human sperm motility parameters,reactive oxygen species levels and nitric oxide levels[J].Andrologia,2010,42(3):206-210.
[17] 白文静.脯氨酸对猪精液常温保存效果的研究[D].杨凌:西北农林科技大学,2018.BAI W J.Effect of proline on boar semen quality during normal temperature preservation[D].Yangling:Northwest A & F University,2018(in Chinese with English abstract).
[18] PIPAN M Z,MRKUN J,STRAJN B J,et al.The influence of macro- and microelements in seminal plasma on diluted boar sperm quality[J].Acta veterinaria scandinavica,2017,59(1):1-9.
[19] 曾耀,孙琳琳,吴德,等.猪精液常温保存抗氧化剂研究进展[J].中国畜牧杂志,2020,56(3):12-18.ZENG Y,SUN L L,WU D,et al.Research progress on antioxidant of boar sperm in process of liquid preservation[J].Chinese journal of animal science,2020,56(3):12-18(in Chinese with English abstract).
[20] 李井春,李琦,唐德江,等.不同渗透压的稀释液对猪精液17 ℃保存效果的影响[J].黑龙江畜牧兽医,2017(17):118-120.LI J C,LI Q,TANG D J,et al.The effect of different osmotic pressures on the preservation of boar semen at 17 ℃[J].Heilongjiang animal science and veterinary medicine,2017(17):118-120(in Chinese with English abstract).
[21] 李琦,李井春,李雁冰,等.不同浓度的鱼精蛋白对猪精液17 ℃液态保存效果的影响[J].中国畜牧杂志,2017,53(8):51-54.LI Q,LI J C,LI Y B,et al.Effects of different concentrations of protamine on quality of boar semen stored at 17 ℃[J].Chinese journal of animal science,2017,53(8):51-54(in Chinese with English abstract).
[22] KILLIAN G J,CHAPMAN D A,ROGOWSKI L A.Fertility-associated proteins in Holstein bull seminal plasma[J].Biology of reproduction,1993,49(6):1202-1207.
[23] BELLIN M E,OYARZO J N,HAWKINS H E,et al.Fertility-associated antigen on bull sperm indicates fertility potential[J].Journal of animal science,1998,76(8):2032-2039.
[24] 胡亚美.虾青素对猪精液常温保存效果的研究[D].杨凌:西北农林科技大学,2018.HU Y M.Effects of astaxanthin on the quality of semen during normal temperature preservation[D].Yangling:Northwest A & F University,2018(in Chinese with English abstract).
[25] 何兰花,周美华,陆少华,等.猪精液常温保存的试验[J].黑龙江动物繁殖,2005,13(4):8-9.HE L H,ZHOU M H,LU S H,et al.Study on preservation of boar semen at normal temperature[J].Heilongjiang journal of animal reproduction,2005,13(4):8-9(in Chinese).
[26] 邢月超,汪顺伟,孙梦,等.稳定pH值对猪精液液态保存效果的影响[J].黑龙江畜牧兽医,2018(1):103-107.XING Y C,WANG S W,SUN M,et al.The contribution of stable pH value on the improvement of liquid storage of boar semen[J].Heilongjiang animal science and veterinary medicine,2018(1):103-107(in Chinese with English abstract).
[27] 侯丽鹏,王鹏,马玲琴,等.不同常温保存稀释液对猪精液保存效果的影响[J]中国畜牧杂志,2012,48 (17):23-26.HOU L P,WANG P,MA L Q,et al.Effect of different diluents on preservation of boar semen at normal temperature[J]. Chinese journal of animal science,2012,48(17):23-26(in Chinese).
[28] 王文国.男性不育患者精液质量与精子顶体酶活性的关系研究[J].临床检验杂志(电子版),2018,7(2):229-230.WANG W G.Study on the relationship between semen quality and sperm acrosin activity in male infertile patients[J].Clinical laboratory journal (electronic edition),2018,7(2):229-230(in Chinese).
[29] 侯丽鹏.不同稀释液对猪精液常温保存效果的影响[D].杨凌:西北农林科技大学,2012.HOU L P.Effects of different extenders on boar semen normal temperature preservation[D].Yangling: Northwest A & F University,2012(in Chinese with English abstract).
[30] 耿果霞,李雪涛,石美虹,等.弱酸性环境对猪精液常温保存的影响[J].家畜生态学报,2013,34(11):37-40.GENG G X,LI X T,SHI M H,et al.The effect of weak acidic environment on swine semen with normal temperature preservation[J].Journal of domestic animal ecology,2013,34(11):37-40(in Chinese with English abstract).
[31] 卫帅毅.猪精液常温保存稀释粉保存效果研究[D].杨凌:西北农林科技大学,2016.WEI S Y.Effect of diluent powder on quality of boar semen stored at room temperature[D].Yangling:Northwest A & F University,2016(in Chinese with English abstract).
[32] ROS-SANTAELLA J L,PINTUS E.Rooibos (Aspalathus linearis) extract enhances boar sperm velocity up to 96 hours of semen storage[J/OL].PLoS One,2017,12(8):e0183682[2020-07-31].https://doi.org/10.1371/journal.pone.0183682.
[33] 侯震坤,魏宁,刘兆军, 等.曲酸对关中黑猪精液常温保存的影响[J].养猪,2017(5):37-40.HOU Z K,WEI N,LIU Z J,et al.Effects of kojic acid on the quality of boar semen of Guanzhong black pig during room temperature preservation[J].Swine production,2017(5):37-40(in Chinese with English abstract).