传统的检测方法大多依赖于精密仪器,虽然测定准确、灵敏度高,但仪器价格高、难以便携、操作复杂,从而限制了其在现场检测中的应用[1-2]。因此,越来越多的科研工作者致力于研究快速、便捷、简单的检测手段,以期能够有效监测食品安全问题以及实现临床早期诊断,快速检测技术应运而生。
近年来,各种快速检测技术被报道,其中生物传感器备受关注。生物传感器是一种由物理、化学、生物等多学科交叉融合而发展起来的高新检测技术,主要通过生物分子识别元件(如抗体、酶、核酸等)识别目标物,然后利用信号转换器将其转换为光、电、磁等易于捕获识别的信号,进而实现目标物简易高效分析的方法。因其检测快速、自动化程度高、易于操作,生物传感器已经在生物化学分析、食品安全检测、环境监测等领域得到了广泛应用,主要包括电化学生物传感器、光学生物传感器等[3-5],但这些生物传感器大多仍然受到精密仪器、检测经济性、样品基质干扰等方面的影响,其性能在快速检测方面尚需进一步提高。磁弛豫(magnetic relaxation switching,MRS)生物传感器是近年来多次被报道的生物传感技术之一。MRS传感器是以磁弛豫时间作为读出信号,进行目标物定性定量的快速检测技术,具有检测快速、操作简单、信噪比高、易于实现现场检测等优点,是快速检测领域最受关注的研究方向之一。本研究围绕MRS传感器的传感机制、研究进展、应用领域等方面进行了介绍,并对MRS传感器的发展进行了展望,以期能够促进快速检测技术的进一步发展。
1 磁弛豫生物传感器介绍
磁弛豫生物传感器(MRS)的发展开始于磁纳米颗粒介导的水分子弛豫时间缩短现象的发现。在物理学上,弛豫指的是某种平衡状态被破坏后,又恢复到平衡态的过程,用弛豫时间来衡量弛豫过程的快慢。在核磁共振中,弛豫过程分为纵向弛豫(又称为自旋-晶格弛豫)和横向弛豫(又称为自旋-自旋弛豫),分别用纵向弛豫时间(longitudinal relaxation time,T1)和横向弛豫时间(transverse relaxation time,T2)进行衡量。2002年, Weissleder课题组[6]首次报道了磁弛豫现象,当超顺磁纳米颗粒(superparamagnetic nanoparticles,MNPs,简称为磁颗粒)在水溶液中的状态(分散或聚集)发生变化时,能够引起其局部磁场均匀性发生改变,形成非均匀局部磁场,而不均匀磁场可加快周围水分子质子的横向弛豫速度,进而缩短横向弛豫时间[7-11]。目前,磁弛豫时间传感现象以及相应传感器的开发仍是研究的热点之一。基于对磁弛豫传感现象的深入研究,各式各样的MRS传感器被开发和完善并广泛应用于食品安全检测、临床诊断分析、环境监测等领域[12-16](图1),配合便携式的微型核磁共振仪,可实现现场快速检测。
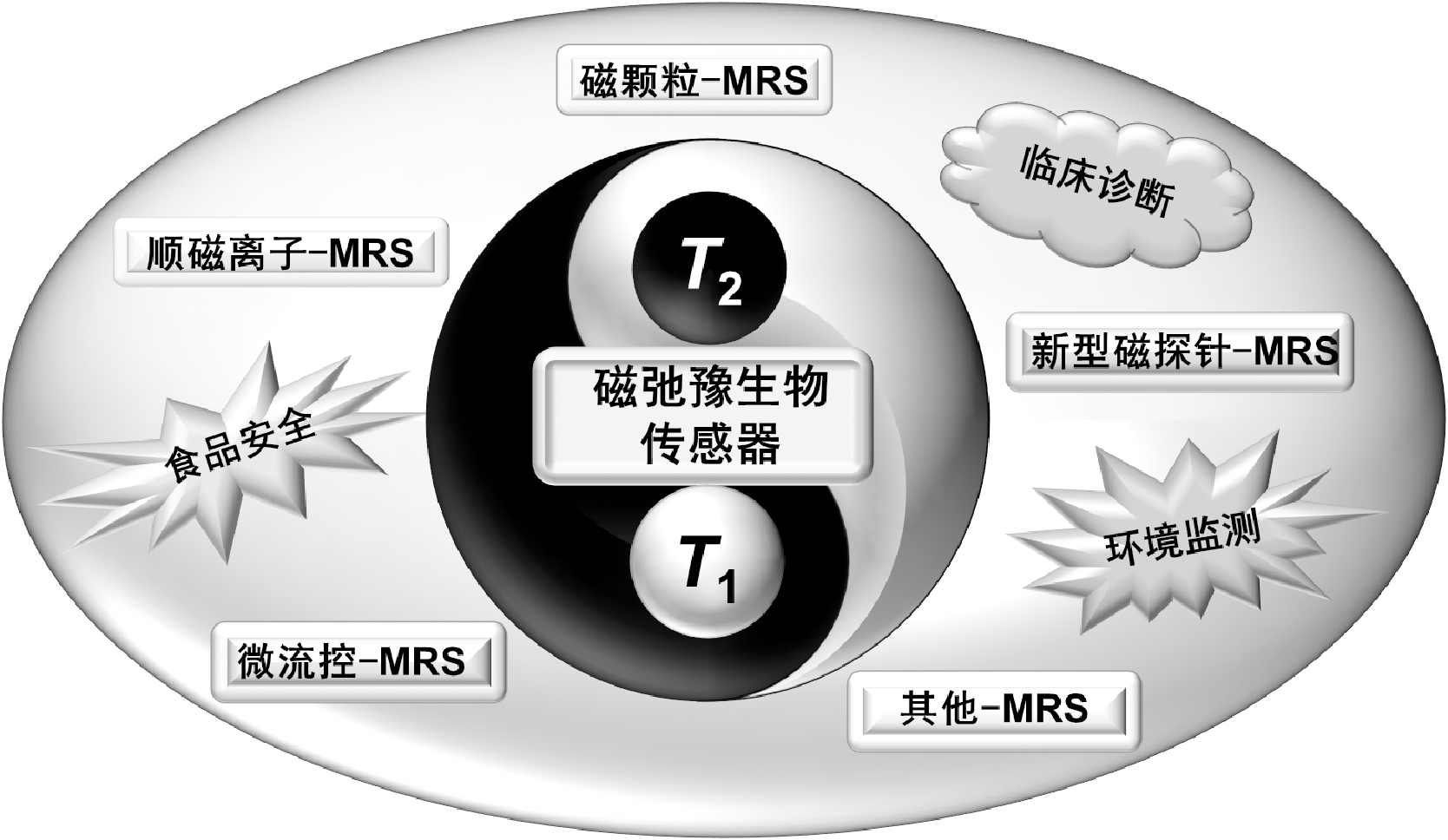
图1 磁弛豫生物传感器分类及其应用
Fig.1 Classification and application of magnetic relaxation switching biosensors
2 磁弛豫生物传感器分类
2.1 磁颗粒介导的MRS
1)基于磁颗粒状态改变的MRS。基于磁颗粒状态改变的MRS的基本原理是将磁颗粒进行表面修饰,在其表面偶联上给体/受体(例如抗原/抗体、生物素/链霉亲和素、适配体等),从而制备成特异性磁信号探针,在检测分析过程中通过给体-受体的特异性识别作用导致其状态由分散变成聚集,从而产生磁弛豫传感现象(状态的改变会影响局部磁场的均匀性,周围水分子扩散经过这些不均匀磁场时导致质子横向弛豫加速,缩短横向弛豫时间(T2)[17-21],其中,磁探针状态改变的程度、T2的改变量均与样品中目标物含量成正相关,从而达到定量定性检测的目的。
Perez等[22]率先构建了基于磁颗粒状态改变的MRS免疫传感器并用于与人类疾病密切相关的血清中疱疹病毒和腺病毒的快速灵敏检测(图2A)。该方法检出限为5个病毒/10 μL血清(25%的蛋白),并且由于无需PCR扩增过程,有效提高了检测效率,具有快速、高灵敏等优点。Kaittanis等[23]基于同样的原理建立了检测血清和牛奶中副结核鸟分枝杆菌(Mycobacterium avium spp. paratuberculosis,MAP)的磁免疫传感方法,检出限可达到15.5 CFUs(colony forming units,CFUs),远远低于其他传统方法。MRS免疫传感器有以下几个优点:(a)分析速度快,因为磁颗粒的存在,检测中可以通过磁分离而缩短分析时间;(b) 信噪比高,将磁颗粒作为磁信号探针,大多数样品中的磁信号可以忽略不计,是一种均相免疫分析方法;(c) 特异性强,基于抗原与抗体的特异性结合,该方法具有良好的特异性;(d) 所需样品量少。但传统的MRS免疫传感器由于是基于磁颗粒状态的改变,磁信号只在一定范围内和目标物的浓度成正相关,检测的线性范围较窄。此外,由于磁颗粒的状态改变容易受到样品基质等多因素的干扰,产生非特异性聚集,导致方法的稳定性较差。
为解决传统基于磁颗粒状态MRS的局限性,科研工作者开展了大量的工作。其中,采用新型的磁颗粒聚集介导信号放大策略能够有效提高生物传感器性能。Chen等[24]构建了一种基于磁/银纳米粒子自组装的磁弛豫生物感应分析方法,并用于氯霉素(chloramphenicol,CAP)的高灵敏检测。氯霉素是一种可以人工合成的广谱性抗生素,滥用的CAP能够通过食物链在人体富集,并产生细菌耐药性、降低免疫力等严重危害[25]。我国农业农村部早在2003年第235号公告中就将CAP及其盐、酯类列入禁用药物,并明确规定在所有动物性食品中不得检出CAP。该方法的原理是基于竞争性免疫反应,不同浓度的氯霉素竞争结合不同量的碱性磷酸酶(alkaline phosphatase,ALP)标记的单克隆抗体(alkaline phosphatase-antibody,ALP-Ab),ALP-Ab中的ALP能够催化抗坏血酸酯去磷酸化,产生具有还原性的抗坏血酸盐,进而将银离子还原为银纳米颗粒,磁纳米颗粒进一步在其表面组装形成磁/银纳米粒子,使磁颗粒由原先的单分散状态变为聚集状态,导致T2信号的变化,从而对目标物进行定量分析。在本方法中ALP的催化放大作用及银颗粒引导的信号产生和读出机制,有效提高了磁弛豫传感器的灵敏度。与传统MRS免疫传感器相比,此传感器的灵敏度提高了50倍,分析性能良好,在有害小分子检测方面具有良好的潜力。
2)基于磁颗粒数量变化的MRS。基于磁颗粒数量变化的MRS是一种新型的磁弛豫生物传感分析方法。其基本原理是基于大小不同的磁颗粒在同一磁场中的分离速度的差异,将大粒径的磁颗粒作为免疫磁分离的载体,小粒径的磁颗粒作为磁信号探针,通过修饰有给体/受体的载体特异性识别修饰有受体/给体的磁颗粒,经磁分离等操作后,使磁探针数量发生变化,从而实现生物传感。相对于基于磁颗粒状态改变MRS,该类型传感器不需要诱导磁颗粒的聚集,有效提高了MRS的稳定性。此外,T2信号对磁探针的浓度的改变更为敏感,具有更高的响应,有效提高了MRS传感器的灵敏度。

图2 磁颗粒介导的MRS生物传感器
Fig.2 Magnetic nanoparticles-mediated MRS biosensors
关于磁颗粒数量变化介导的MRS生物传感器的研发,国内外均有此方面的报道。Chen等[26]将磁分离(magnetic separation,MS)与MRS相结合,构建了一种基于磁颗粒数量变化的MRS生物传感平台,并成功应用于致病菌与病毒的快速检测(图2B)。该方法主要基于大粒径磁颗粒(250 nm磁颗粒,MNP250)与小粒径磁颗粒(30 nm磁颗粒,MNP30)在小磁场(0.01 T)中具有不同的分离速度,MNP250由于具有高饱和磁化强度,能够在1 min内被0.01 T磁场快速分离,而MNP30由于饱和磁化强度较低,在相同条件下,60 min尚不能磁分离完全。Chen等[26]将MNP250作为磁分离的载体并偶联捕获抗体,将MNP30作为磁信号探针并偶联检测抗体,当目标物存在时,经过特异性免疫反应能够形成MNP250-目标物-MNP30双抗夹心结构。由于磁分离速度的不同,可以轻易地将MNP250-目标物-MNP30与反应体系中未反应的MNP30分离,从而获得未反应的MNP30,对其进行T2信号测定,实现定量分析。该方法集样品富集、提取、检测一步完成,整个免疫分析过程能够在30 min内完成,操作简单,灵敏度高,具有良好的快速检测的潜力。此外,2013年,Chung等课题组[27]基于磁颗粒-DNA探针,结合分子杂交实验,构建了临床样品中致病菌的生物传感器分析系统(图2C)。此工作通过RT-PCR技术对所提取RNA的目标区域进行特异性扩增,得到大量的单链DNA,此DNA能够被偶联有寡核苷酸捕获探针的聚合微球所捕获,得到聚合微球-DNA,聚合微球-DNA进而与偶联有检测探针的磁颗粒(MNP)结合,得到聚合微球-DNA-MNP,由于大量MNP结合到聚合微球上,可显著降低周围水分子的T2值。该方法实现了三步信号扩增:(1)PCR扩增;(2) 聚合微球对目标核酸分子的捕获与富集;(3) 磁信号扩增。该方法稳定快速,能够在2 h内同时诊断临床标本中的13种细菌。更重要的是,其课题组所使用的微型核磁共振仪为快速检测提供了有力的工具。Lu等[28]构建了一种基于磁颗粒数量变化的MRS生物传感方法,并将其用于微小RNA(MicroRNA,miRNA)的高灵敏定量分析(图2D)。miRNA是一种小的、非编码的RNA分子,由大约22个核苷酸组成,参与基因表达的转录和调控。miRNA的异常表达可能导致DNA扩增或易位,导致肿瘤增生或转移,其快速准确检测能够为临床诊断及癌症治疗提供重要的参考依据[29]。此工作组装了一种“大磁颗粒-DNA-小磁颗粒”(MM1000-DNA-MN30)磁探针,当目标miRNA存在时,双链特异性核酸酶(DSN)能够特异性切割通过杂交生成的DNA-RNA异源双链核酸分子,从而引导miRNA和MN30的释放,释放的MN30通过不同粒径磁颗粒分离速度的不同与磁探针进行分离,最后对上清液中MN30的进行定量分析。与传统MRS相比,此方法能够在目标物存在的情况下,直接释放MN30,并将其作为信号源进行信号读出,是一种信号打开的方式,稳定性良好。此外,释放的miRNA又可以作为目标物进行新一轮的杂交反应,释放MN30,使得信号放大,显著提高传感方法的灵敏度,能够实现尿液样品中miR-21高灵敏的一步检测(5 fM),在临床即时诊断方向具有良好的应用前景。
3)磁颗粒状态与数量同时变化的MRS。在检测农兽药残留等小分子有害物质时,农兽药小分子通常只有1个可以和抗体特异性结合的位点,引起的磁信号改变微弱,导致传统MRS灵敏度无法对小分子目标物实现痕量检测。为了解决此问题, Zheng等[30]构建了一种基于生物正交反应进行信号级联放大,集磁颗粒状态与数量变化于一体的MRS传感平台,并将其用于农药残留毒死蜱的痕量分析。毒死蜱因其广谱性,已成为农业生产中广泛使用的有机磷杀虫剂。然而,长期接触有机磷农药会对人体神经系统、生殖系统和免疫系统造成损害,对人体健康构成严重威胁[31]。在本方法中,毒死蜱分子会与MNP1000-BSA-毒死蜱竞争性结合二苯并环辛炔(DBCO)修饰的单克隆抗体(Ab-DBCO),得到的“MNP1000-BSA-毒死蜱-Ab-DBCO”复合物上具有多个DBCO位点,能够捕获大量的azide-MNP30(DBCO能够与叠氮化物(azide)发生生物正交反应),通过磁分离效率的不同可得到未反应的azide-MNP30(磁颗粒数量变化),通过加入生物交联剂DBCO-PEG4-DBCO进一步诱导DBCO和叠氮化物基团之间的生物正交反应使分散的azide-MNP30聚集(磁颗粒状态变化)。试验结果表明,该传感器能够实现对毒死蜱0.1~1 000 ng/mL的定量检测,检出限为0.05 ng/mL。该传感器的高效与高灵敏主要得益于:(1) 叠氮化物与DBCO的生物正交反应具有快速、高选择性的特点,是实现信号放大而不引入交叉反应的重要手段,特别是在复杂样品中;(2) 单一抗体对azide-MNP30显示出多个DBCO位点,这将增大由单个靶标诱导MNP30的结合量,从而使信号放大;(3) 生物交联剂DBCO-PEG4-DBCO诱导的azide-MNP30聚集,使传感信号进一步放大。该传感器通过生物正交反应将MNPs数量变化引起的信号放大与MNPs状态变化引起的信号放大有机结合起来,实现磁信号的级联放大,有效提高了生物传感器的灵敏度和检测范围。
Wu等[32]利用碱性磷酸酶介导的点击化学反应作为信号转化与放大系统,构建了双重模式的MRS生物传感器。该工作通过Cu+催化叠氮化物和炔的1,3-偶极环加成的点击化学反应(CuAAC)诱导磁颗粒的状态变化或调节磁探针数量变化。如图2E所示,当小分子目标物存在时,包被在96孔板上的目标物-BSA能够与目标物竞争性结合单克隆抗体(Ab),洗涤并加入碱性磷酸酶(ALP)标记的羊抗小鼠IgG,可得到与目标物成反比的“BSA-目标物-Ab-IgG (ALP)”。ALP能够将磷酸化抗坏血酸(AAP)去磷酸化,生成具有还原性的抗坏血酸(AA),能够将Cu2+还原为Cu+,进而用于CuAAC点击化学反应,使修饰有叠氮分子(azide)的磁颗粒与修饰有炔分子(alkyne)的磁颗粒聚集。该MRS生物传感器分为2种模式(aMRS和nMRS):aMRS模式是基于MNP30-azide与MNP30- alkyne经CuAAC催化变为聚集状态,产生T2信号变化;nMRS是基于MNP30-azide与MNP1000-alkyne经CuAAC催化变为聚集状态,进而通过磁分离得到未反应的MNP30-azide(磁分离速度不同),并对其进行T2信号读出,此模式是基于磁颗粒数量的变化。研究结果表明,该传感器能够实现食品基质中兽药残留的快速高灵敏检测,其线性检测范围为0.1~500 ng/mL,检出限为0.02 ng/mL,并且所提供的双模式分析有效拓宽了该生物传感器的适用性与实用性,为食品安全领域中农兽药残留及其他领域中有害小分子的快速检测提供了有力的工具。
2.2 顺磁离子介导的MRS
在顺磁离子溶液中,顺磁离子含有的多个不成对电子能够与氢质子发生空间偶极-偶极相互作用,从而改变水分子的纵向弛豫时间(T1)[10,33-35]。在此方面,笔者所在团队进行了开创性的工作。不同价态的顺磁离子通常具有不同的T1信号。以Fe2+/Fe3+为例,与Fe3+相比,Fe2+未成对电子较少,电子弛豫时间较短,具有较低的T1弛豫效率[36]。基于此性质, Chen等[37]首次将顺磁离子(Fe2+/Fe3+) 作为磁信号探针,开发了一种通过氧化还原反应实现Fe2+/Fe3+价态转换和改变T1信号的分析方法,并用于生化分析和免疫检测(图3A)。为了进一步提高该传感器的灵敏度, Dong等[38]将Fe3+与SCN-之间的络合反应引入Fe2+/Fe3+介导的MRS传感器中,将Fe2+转化为Fe3+引起的磁信号改变进一步放大,实现了对牛奶中四环素的准确分析和快速检测(图3B)。此外, Dong等[39]也将Cu2+/Cu+作为磁信号探针,基于 Cu2+和Cu+的转换引起磁信号改变,并用水苏二磺酸二钠水合物(BCS)螯合Cu+,形成Cu+-BCS配合物,有效地解决了Cu+在水溶液中不稳定的问题,实现了对牛奶中磺胺类抗生素的检测(图3C)。但Fe2+/Fe3+和Cu2+/Cu+体系中,顺磁离子本身都具有磁信号,导致背景值较高,灵敏度有待进一步提高。研究发现,Mn2+具有特别强的磁信号,而Mn7+没有磁信号,因此 Mn2+/Mn7+是一个零背景的磁信号探针,同样可以通过氧化还原反应实现 Mn2+和Mn7+的转化。Wang等[40]以Mn2+/Mn7+磁信号探针构建了MRS免疫传感器,并将其用于小分子目标物及致病菌的高灵敏检测(图3D)。其主要原理是将ALP标记到识别目标物的抗体上,基于竞争性免疫反应或双抗夹心免疫反应,实现ALP与目标物的相关性关联,该ALP可以将抗坏血酸酯去磷酸化,进而转化为具有还原性的抗坏血酸,而抗坏血酸可以将Mn7+转变为Mn2+,进而引起磁信号从无到有的改变,从而实现目标物的定量分析。试验结果发现,相比于Fe2+/Fe3+-MRS和Cu2+/Cu+-MRS传感器,Mn2+/Mn7+介导的MRS免疫传感器灵敏度提高了两个数量级。因为许多物质本身是氧化还原剂(例如,H2O2、抗坏血酸等)或经过酶促反应等生物化学反应转化为氧化还原剂(例如,葡萄糖经葡萄糖氧化酶催化后产生H2O2)都能够实现顺磁离子的价态转换,因此该类传感器可以检测一系列的目标物,并且可以结合免疫反应等方法对目标物进行分析,极大地拓宽了磁生物传感器的应用范围。此外,与基于磁颗粒的MRS相比,以顺磁离子为磁信号探针的MRS传感器具有良好的稳定性,顺磁离子在水溶液中稳定性良好,避免了超顺磁纳米颗粒在复杂基质中易发生聚集的问题,抗干扰能力更强,且反应简单快速,对环境要求低,是快速检测领域一个新的开发点。
2.3 基于新型磁探针的MRS
构建新型的磁探针是提升MRS生物传感器分析性能的有效方式。近年来,已有多篇关于新型磁探针的合成、表面修饰、可控组装及相应MRS构建的报道[19,41-45]。Xianyu等[46]制备了不同磁信号强度的新型磁探针,实现了食品基质中不同限量标准(pg/mL~μg/mL) 抗生素的线性可调检测(图4A)。利用点击化学反应将30 nm小磁颗粒组装在不同粒径聚苯乙烯微球(polystyrene beads,PS)表面,因为不同粒径的PS微球表面偶联的纳米磁颗粒的数量不同,因此可以制备不同磁信号强度的磁探针。当目标抗生素存在时,能够与“MNP-BSA-目标抗生素”竞争性结合偶联单克隆抗体的磁探针(可调),经磁分离后可得到捕获目标抗生素的磁探针,并对其进行T2信号测定。可根据目标抗生素的限量标准,选择不同信号强度的磁探针,从而实现不同限量标准抗生素的线性可调检测。该MRS免疫传感方法最大的优点是采用不同粒径的聚苯乙烯微球实现了整个方法线性范围的可调(pg/mL~μg/mL),可以实现质量浓度范围不同的多个目标物的检测,具有检测范围宽、快速、灵敏等特点,在食品安全检测、生物医学诊断等方面具有广阔的应用前景。

图3 顺磁离子介导的MRS生物传感器
Fig.3 Paramagnetic ion mediated MRS biosensors

图4 新型磁探针介导的MRS生物传感器
Fig.4 Novel magnetic probe mediated MRS biosensors
为了实现高灵敏和快速检测的有机统一, Xianyu等[47]近期构建了一种集磁分离与磁传感于一体新型磁信号探针的MRS免疫传感器(图4B)。该工作首先将多聚赖氨酸和单克隆抗体(Ab)可控地组装到纳米磁颗粒(MNP150)的表面,得到具有多维空间网状树枝结构的“Ab-MNP150-多聚赖氨酸”偶联物,然后将对Gd3+离子具有很好螯合性能的DOTA偶联在多聚赖氨酸的表面,通过DOTA捕获Gd3+,最终将大量的Gd3+离子螯合在MNP150表面,得到“Ab-MNP150-多聚赖氨酸-DOTA-Gd3+”多重信号放大的纳米免疫磁探针。其中,Gd3+是具有强的磁信号的顺磁离子[48],通过多聚赖氨酸可增加Gd3+的偶联量为一重信号放大过程,磁颗粒与Gd3+磁信号的协同效应为多重信号放大过程。将该磁探针与竞争性免疫反应相结合,可实现小分子目标物的高灵敏检测。与传统的MRS免疫传感器相比,灵敏度提高了25倍,在实际样品的检测中,和经典的高效液相色谱-质谱方法具有很好的吻合性。更为重要的是该磁信号探针同时可以作为免疫磁分离的载体,实现目标物的有效富集和快速检测的一步完成,大大简化了整个方法的操作步骤,提高了检测效率,在快速检测方面具有良好的潜力。
除上述可控组装策略外,对磁颗粒进行表面修饰也是构建新型磁探针、提升传感器性能的有效方式。Lee等[49]通过金属配位将聚乙二醇改性的胆红素(poly(ethylene glycol)-modified bilirubin (PEG-BR),PEG-BR)包被于超顺磁性氧化铁纳米颗粒(SPIONs)表面,制备了PEG-BR@SPIONs磁探针,并用于活性氧(ROS)的检测(图4C)。其基本原理是:当ROS存在时,PEG-BR包覆层能够被氧化为水溶性的PEG-胆绿素,并进一步被氧化为终产物,进而从SPIONs表面脱落。在生物环境中,由于吸引力和不稳定性,脱落包覆层的SPIONs相互聚集,产生状态变化,从而实现ROS的定量分析。研究结果表明,PEG-BR@SPIONs磁探针具有高胶体稳定性,能够实现生理学环境下ROS的高灵敏分析,在临床诊断领域具有良好的应用前景。随着纳米材料及纳米科技的发展,新型纳米磁探针将是磁弛豫生物传感分析方向具有代表性的突破点之一。
2.4 微流控芯片MRS
微流控芯片技术又被称为芯片上的实验室(lab-on-a-chip),具有分析速度快、样品用量少、自动化程度高、检测成本低等优点,在生化分析、临床诊断、公共卫生监测等方面应用广泛[19,50-54]。Lee等[55]将微流控芯片技术、磁生物传感技术与微型核磁共振仪结合开发了一种小型诊断磁共振(DMR)系统(图5)。
该DMR系统主要包括四部分:用于核磁共振测量的微线圈阵列、用于样品处理和混合的微流体网络、微型核磁共振电子器件和用于产生极化磁场的永磁体。该系统将多个平面微线圈排列在一个阵列中,可实现多通道检测,并能较好地适应器件的小型化;微流体系统便于控制小体积液体和实现目标物的分离富集。此外,该系统引入基于磁颗粒状态改变的MRS,实现信号的放大与读出。整个DMR系统可被设计为独立便携的设备,能够实现细菌、蛋白生物标志物等目标物的快速检测。此工作所开发的微型核磁共振仪为第一代产品(DMR-1),该课题组还对其进行了升级,例如第二代DMR系统(DMR-2)[56] 、第三代DMR系统[57]等,在进样体积、射频磁场均匀性、温度控制、便携性等多方面进行了优化,拓宽了其应用范围,在快速检测方向具有良好的推动作用[58-59]。
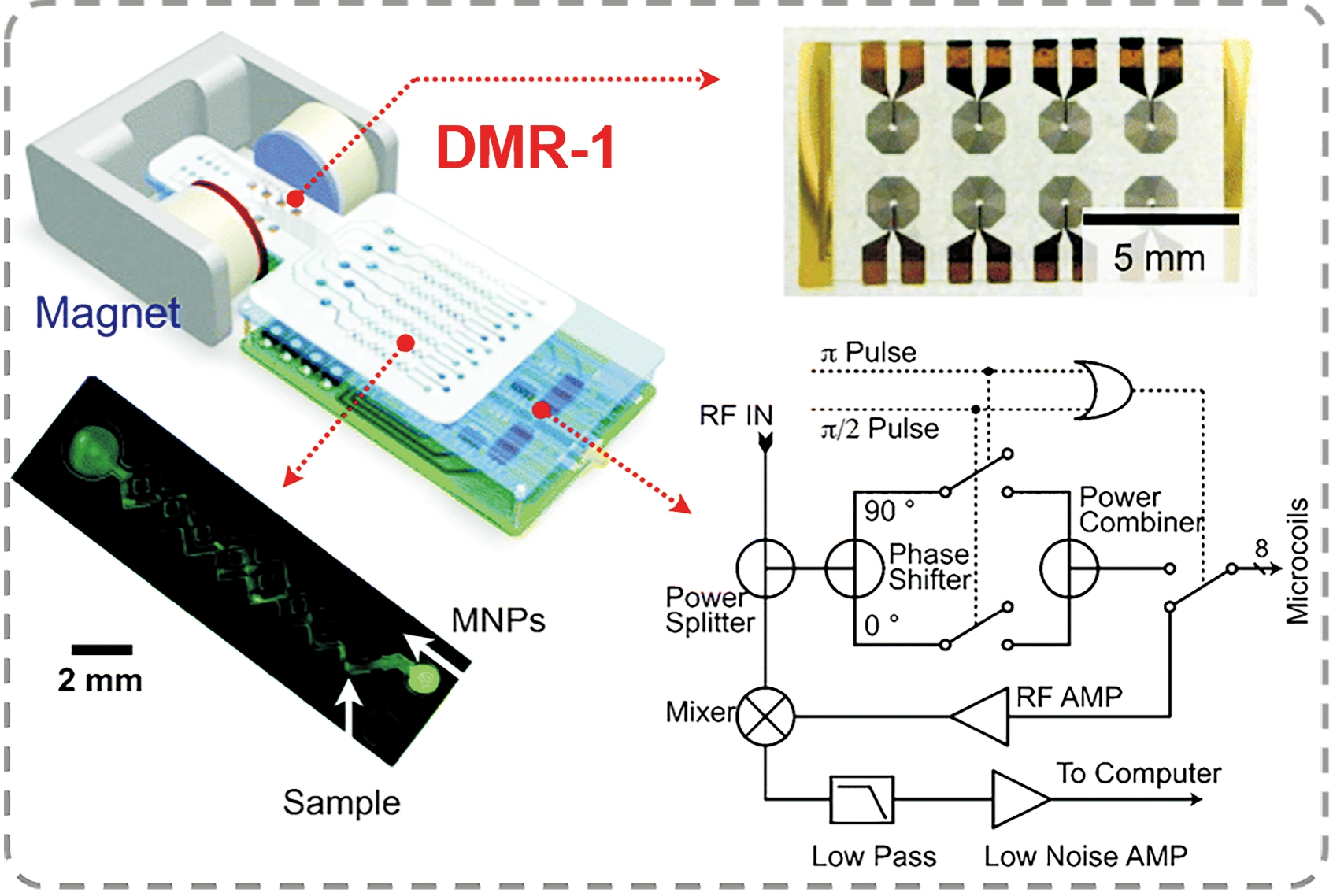
图5 微流控芯片介导的小型诊断磁共振(DMR)系统
Fig.5 Microfluidic chip mediated miniaturized
diagnostic magnetic resonance (DMR) system
3 讨论与展望
磁弛豫生物传感器作为一种集物理、化学、生物等多学科交叉的新型分析技术,具有分析速度快、信噪比高、操作简单等优点,基于不同原理的磁弛豫生物传感器(例如基于磁颗粒状态/数量变化的磁弛豫传感器、基于顺磁离子的磁弛豫传感器等)已经应用于食品安全和临床诊断等多个领域,对快速检测技术的发展具有重要的推动作用。我们相信未来在以下几个方面开展深入研究将会推动磁弛豫生物传感器得到更广泛的应用:
(1)开发新型磁纳米探针。随着纳米科学技术的发展,各种纳米材料层出不穷,为寻找和可控组装性能优良的磁纳米探针提供了有利的条件。此外,新型磁纳米探针的开发能够有效提高磁弛豫生物传感器的信号读出性能,拓宽磁弛豫生物传感器在快速检测领域的应用。
(2)多重目标物同时检测及高通量检测进一步发展。在临床诊断、食品安全、环境监测等领域中均存在大量种类和数量的目标物需要快速检测,开发多重目标物同时检测和高通量的磁弛豫生物传感器或基于磁弛豫生物传感器的快速检测平台具有重要的现实意义。
(3)磁弛豫传感器的自动化、智能化和便携化。虽然已有基于微流控芯片的DMR系统的报道,但目前大部分磁弛豫生物传感器在智能化、自动化、便携化方面仍存在一定的不足,需要不断与其他学科交叉融合,提高磁弛豫生物传感器在此方面的性能。
(4)新型磁弛豫传感机制的探索。新型的磁弛豫传感机制是构建新型磁弛豫生物传感器的基础,能够从根本上推动磁弛豫传感技术的进一步发展,也是本领域研究人员需要持续关注的重点。
[1] LI X,PAN X M,LU J M,et al.Dual-modal visual/photoelectrochemical all-in-one bioassay for rapid detection of AFP using 3D printed microreactor device[J/OL].Biosens bioelectron,2020,158:112158 [2020-10-19].https://doi.org/10.1016/j.bios.2020.112158.
[2] DONG Y Z,ZHENG W S,CHEN D,et al.Click reaction-mediated T2 immunosensor for ultrasensitive detection of pesticide residues via brush-like nanostructure-triggered coordination chemistry[J].J Agric Food Chem,2019,67 (35):9942-9949.
[3] GARCIA-RUBIO D L,DE LA MORA M B,CERECEDO D,et al.An optical-based biosensor of the epithelial sodium channel as a tool for diagnosing hypertension[J/OL].Biosens bioelectron,2020,157:112151 [2020-10-19].https://doi.org/10.1016/j.bios.2020.112151.
[4] SONG Y C,XU T L,ZHU Q L,et al.Integrated individually electrochemical array for simultaneously detecting multiple Alzheimer’s biomarkers[J/OL].Biosens bioelectron,2020,162:112253 [2020-10-19].https://doi.org/10.1016/j.bios.2020.112253.
[5] XU L Z,SHOAIE N,JAHANPEYMA F,et al.Optical,electrochemical and electrical (nano)biosensors for detection of exosomes:a comprehensive overview[J/OL].Biosens bioelectron,2020,161:112222 [2020-10-19].https://doi.org/10.1016/j.bios.2020.112222.
[6] PEREZ J M,JOSEPHSON L,O'LOUGHLIN T,et al.Magnetic relaxation switches capable of sensing molecular interactions[J].Nat Biotechnol,2002,20 (8):816-820.
[7] ZHOU Z J,TIAN R,WANG Z Y,et al.Artificial local magnetic field inhomogeneity enhances T2 relaxivity[J/OL].Nat Commun,2017,8:15468[2020-10-19].https://doi.org/10.1038/ncomms15468.
[8] TSOURKAS A,HOFSTETTER O,HOFSTETTER H,et al.Magnetic relaxation switch immunosensors detect enantiomeric impurities[J].Angew Chem Int Ed,2004,43 (18):2395-2399.
[9] DANIEL K D,KIM G Y,VASSILIOU C C,et al.Implantable diagnostic device for cancer monitoring[J].Biosens bioelectron,2009,24 (11):3252-3257.
[10] ZHOU Z J,BAI R L,MUNASINGHE J,et al.T1-T2 dual-modal magnetic resonance imaging:from molecular basis to contrast agents[J].ACS nano,2017,11 (6):5227-5232.
[11] XIAO J,ZHANG G,QIAN J,et al.Fabricating high-performance T2-weighted contrast agents via adjusting composition and size of nanomagnetic iron oxide[J].ACS Appl Mater Interfaces,2018,10 (8):7003-7011.
[12] XIANYU Y L,WANG Q L,CHEN Y P.Magnetic particles-enabled biosensors for point-of-care testing[J].Trends Anal Chem,2018,106:213-224.
[13] YANG L,WANG Z,MA L,et al.The roles of morphology on the relaxation rates of magnetic nanoparticles[J].ACS Nano,2018,12 (5):4605-4614.
[14] COLOMBO M,CARREGAL-ROMERO S,CASULA M F,et al.Biological applications of magnetic nanoparticles[J].Chem Soc Rev,2012,41 (11):4306-4334.
[15] SHIN T H,KANG S,PARK S,et al.A magnetic resonance tuning sensor for the MRI detection of biological targets[J].Nat Protoc,2018,13 (11):2664-2684.
[16] WANG H,YU D,LI B,et al.Ultrasensitive magnetic resonance imaging of systemic reactive oxygen species in vivo for early diagnosis of sepsis using activatable nanoprobes[J].Chem Sci,2019,10 (13):3770-3778.
[17] MIN C,SHAO H L,LIONG M,et al.Mechanism of magnetic relaxation switching sensing[J].ACS nano,2012,6 (8):6821-6828.
[18] TAKTAK S,SOSNOVIK D,CIMA M J,et al.Multiparameter magnetic relaxation switch assays[J].Anal Chem,2007,79 (23):8863-8869.
[19] ZHANG Y,YANG H,ZHOU Z,et al.Recent advances on magnetic relaxation switching assay-based nanosensors[J].Bioconjugate Chem,2017,28 (4):869-879.
[20] JIA F,XU L,YAN W,et al.A magnetic relaxation switch aptasensor for the rapid detection of Pseudomonas aeruginosa using superparamagnetic nanoparticles[J].Microchim Acta,2017,184 (5):1539-1545.
[21] MA W,YIN H,XU L,et al.A PCR based magnetic assembled sensor for ultrasensitive DNA detection[J].Chem Commun,2013,49 (47):5369-5371.
[22] PEREZ J M,SIMEONE F J,SAEKI Y,et al.Viral-induced self-assembly of magnetic nanoparticles allows the detection of viral particles in biological media[J].J Am Chem Soc,2003,125 (34):10192-10193.
[23] KAITTANIS C,NASER S A,PEREZ J M.One-step,nanoparticle-mediated bacterial detection with magnetic relaxation[J].Nano Lett,2007,7 (2):380-383.
[24] CHEN Y P,XIANYU Y L,DONG M L,et al.Cascade reaction-mediated assembly of magnetic/silver nanoparticles for amplified magnetic biosensing[J].Anal Chem,2018,90 (11):6906-6912.
[25] ZHAO M,LI X,ZHANG Y,et al.Rapid quantitative detection of chloramphenicol in milk by microfluidic immunoassay[J/OL].Food Chem,2021,339:127857[2020-10-19].https://doi.org/10.1016/j.foodchem.2020.127857.
[26] CHEN Y P,XIANYU Y L,WANG Y,et al.One-step detection of pathogens and viruses:combining magnetic relaxation switching and magnetic separation[J].ACS nano,2015,9 (3):3184-3191.
[27] CHUNG H J,CASTRO C M,IM H,et al.A magneto-DNA nanoparticle system for rapid detection and phenotyping of bacteria[J].Nat Nanotechnol,2013,8 (5):369-375.
[28] LU W J,CHEN Y P,LIU Z,et al.Quantitative detection of microRNA in one step via next generation magnetic relaxation switch sensing[J].ACS nano,2016,10 (7):6685-6692.
[29] GAO Y,XU S,HE T,et al.Ultrasensitive and specific microRNA detection via dynamic light scattering of DNA network based on rolling circle amplification[J/OL].Sens actuators B,2020,324:128693[2020-10-19].https://doi.org/10.1016/j.snb.2020.128693.
[30] ZHENG W S,ZENG L W,CHEN Y P.Bioorthogonal reactions amplify magnetic nanoparticles binding and assembly for ultrasensitive magnetic resonance sensing[J].Anal Chem,2020,92 (3):2787-2793.
[31] LIU J,KONG D,LIU Z,et al.Three-dimensional mesoporous dendritic fibrous nanosilica as a highly efficient DNA amplification platform for ultrasensitive detection of chlorpyrifos residues[J/OL].Sens actuators B,2020,319:128246[2020-10-19].https://doi.org/10.1016/j.snb.2020.128246.
[32] WU L,XIANYU Y L,WANG Z L,et al.Amplified magnetic resonance densing via enzyme-mediated click chemistry and magnetic separation[J].Anal Chem,2019,91 (24):15555-15562.
[33] MEADE T J,TAYLOR A K,BOLLRS.New magnetic resonance contrast agents as biochemical reporters[J].Curr Opin Neurobiol,2003,13 (5):597-602.
[34] CARO C,GARCIA-MARTIN M L,PERNIA LEAL M.Manganese-based nanogels as pH switches for magnetic resonance imaging[J].Biomacromolecules,2017,18 (5):1617-1623.
[35] LIU Z X,XIANYU Y L,ZHENG W S,et al.T1-mediated nanosensor for immunoassay based on an activatable MnO2 nanoassembly[J].Anal Chem,2018,90 (4):2765-2771.
[36] ZHAO Z H,SUN C J,BAO J F,et al.Surface manganese substitution in magnetite nanocrystals enhances T1 contrast ability by increasing electron spin relaxation[J].J Mater Chem B,2018,6 (3):401-413.
[37] CHEN Y P,YIN B F,DONG M L,et al.Versatile T1-based chemical analysis platform using Fe3+/Fe2+ interconversion[J].Anal Chem,2018,90 (2):1234-1240.
[38] DONG M L,ZHENG W S,CHEN Y P,et al.Fe-T1 sensor based on coordination chemistry for sensitive and versatile bioanalysis[J].Anal Chem,2018,90 (15):9148-9155.
[39] DONG M L,ZHENG W S,CHEN Y P,et al.Cu-T1 sensor for versatile analysis[J].Anal Chem,2018,90 (4):2833-2838.
[40] WANG Z L,XIANYU Y L,ZHANG Z,et al.Background signal-free magnetic bioassay for foodborne pathogen and residue of veterinary drug via Mn(VII)/Mn(II) interconversion[J].ACS Sens,2019,4 (10):2771-2777.
[41] YUAN Y,RENDE D,ALTAN C L,et al.Effect of surface modification on magnetization of iron oxide nanoparticle colloids[J].Langmuir,2012,28 (36):13051-13059.
[42] XIANYU Y L,WU J,CHEN Y P,et al.Controllable assembly of enzymes for multiplexed lab-on-a-chip bioassays with a tunable detection range[J].Angew Chem Int Ed Engl,2018,57 (25):7503-7507.
[43] CHEN Y P,XIANYU Y L,WU J,et al.Click chemistry-mediated nanosensors for biochemical assays[J].Theranostics,2016,6(7):969-985.
[44] ZHOU Z J,HU R,WANG L R,et al.Water bridge coordination on the metal-rich facets of Gd2O3 nanoplates confers high T1 relaxivity[J].Nanoscale,2016,8 (41):17887-17894.
[45] ZHANG W Y,MARTINELLI J,PETERS J A,et al.Surface PEG grafting density determines magnetic relaxation properties of Gd-loaded porous nanoparticles for MR imaging applications[J].ACS Appl Mater Interfaces,2017,9 (28):23458-23465.
[46] XIANYU Y L,DONG Y Z,WANG Z L,et al.Broad-range magnetic relaxation switching bioassays using click chemistry-mediated assembly of polystyrene beads and magnetic nanoparticles[J].ACS Sens,2019,4 (7):1942-1949.
[47] XIANYU Y L,DONG Y Z,ZHANG Z,et al.Gd3+-nanoparticle-enhanced multivalent biosensing that combines magnetic relaxation switching and magnetic separation[J/OL].Biosens bioelectron,2020,155:112106[2020-10-19].https://doi.org/10.1016/j.bios.2020.112106.
[48] WANG Y,YANG T,KE H,et al.Smart albumin-biomineralized nanocomposites for multimodal imaging and photothermal tumor ablation[J].Adv Mater,2015,27 (26):3874-3882.
[49] LEE D Y,KANG S,LEE Y,et al.PEGylated bilirubin-coated iron oxide nanoparticles as a biosensor for magnetic relaxation switching-based ROS detection in whole blood[J].Theranostics,2020,10 (5):1997-2007.
[50] WU Y T,YANG C E,KO C H,et al.Microfluidic detection platform with integrated micro-spectrometer system[J/OL].Chem Eng J,2020,393:124700[2020-10-19].https://doi.org/10.1016/j.cej.2020.124700.
[51] LI X T,LIAO X,LIU Y M.A microfluidic platform integrating paper adsorption-based sample clean-up and voltage-assisted liquid desorption electrospray ionization mass spectrometry for biological sample analysis[J/OL].Talanta,2020,217:121106[2020-10-19].https://doi.org/10.1016/j.talanta.2020.121106.
[52] HE X,GE C,ZHENG X,et al.Rapid identification of alpha-fetoprotein in serum by a microfluidic SERS chip integrated with Ag/Au nanocomposites[J/OL].Sens actuators B,2020,317:128196[2020-10-19].https://doi.org/10.1016/j.snb.2020.128196.
[53] MO Y,LU Z,RUGHOOBUR G,et al.Microfluidic electrochemistry for single-electron transfer redox-neutral reactions[J].Science,2020,368 (6497):1352-1357.
[54] CHEN W W,SHAO F C,XIANYU Y L.Microfluidics-implemented biochemical assays:from the perspective of readout[J/OL].Small,2020,16 (9):e1903388 [2020-10-19].https://doi.org/10.1002/smll.201903388.
[55] LEE H,SUN E,HAM D,et al.Chip-NMR biosensor for detection and molecular analysis of cells[J].Nat Med,2008,14 (8):869-874.
[56] LEE H,YOON T J,FIGUEIREDO J L,et al.Rapid detection and profiling of cancer cells in fine-needle aspirates[J].PNAS,2009,106 (30):12459-12464.
[57] ISSADORE D,MIN C,LIONG M,et al.Miniature magnetic resonance system for point-of-care diagnostics[J].Lab Chip,2011,11 (13):2282-2287.
[58] HAUN J B,YOON T J,LEE H,et al.Magnetic nanoparticle biosensors[J].Nanomed Nanobio,2010,2(3):291-304.
[59] CASTRO C M,GHAZANI A A,CHUNG J,et al.Miniaturized nuclear magnetic resonance platform for detection and profiling of circulating tumor cells[J].Lab Chip,2014,14 (1):14-23.