克氏原螯虾(Procambarus clarkii)具有分布广泛、适应力强、繁殖力高等特点,在我国部分湿地形成自然种群[1],是我国重要的淡水养殖品种之一。2018年克氏原螯虾经济总产值已达3 690亿元,养殖密度的提高以及养殖水体污染等原因,导致克氏原螯虾疾病频发。副溶血性弧菌(Vibrio parahaemolyticus)、嗜水气单胞菌(Aeromonas hydrophila)、拟态弧菌(Vibrio mimicus)等细菌性病原被认为是造成螯虾某养殖业经济损失的原因之一[2-4]。
恩诺沙星enrofloxacin(ENR)作为人工合成的广谱抗菌药,具有对细菌选择性高,口服给药迅速,生物利用度高,半衰期较长,血药浓度、毒副作用小等特点应用于兽医临床,预防和治疗多种细菌和支原体感染,在临床治疗中已成为很多感染性疾病的首选药物,使用频率仅次于青霉素类[5]。
国内外学者采用不同的给药方式,研究了恩诺沙星在水生动物中的药物动力学及残留特征,如银鲫(Carassius auratus gibelio)(肌肉注射)[6]、大菱鲆(Scophthalmus maximus)(静脉注射和口灌)[7]、拟穴青蟹(Scylla paramamosain)(肌肉注射和口灌)[8]、大西洋马蹄蟹(Limulus polyphemus)(围心窦注射)[9]等。本研究分析了在18 ℃和25 ℃ 2种温度下克氏原螯虾围心窦注射20 μg/kg的恩诺沙星后,恩诺沙星及其代谢物环丙沙星(ciprofloxacin,CIP)在虾体内的组织分布和药代动力学特征,以期为制定合理用药量和休药期提供指导。
1 材料与方法
1.1 仪器与设备
Agilent 1200型高效液相色谱仪,Agilent Chemistation色谱工作站,美国Agilent公司;全自动样品快速研磨仪,上海净信实业发展有限公司;MTN-2800W恒温水浴氮吹装置,天津奥赛恩斯仪器有限公司;WH-2微型漩涡混合仪,上海沪西仪器分析厂。
1.2 药品与试剂
恩诺沙星标准品(纯度99%)、环丙沙星标准品(纯度98%),Dr. Ehrenstorfer GmbH公司;色谱级乙腈和甲醇,美国Tedia公司;正己烷、乙腈、三乙胺等试剂为分析纯,购于国药化学试剂有限公司。恩诺沙星原粉(含量99%),上虞京新药业有限公司。
恩诺沙星与环丙沙星标准储备液的配制:分别准确称取0.01 g恩诺沙星及环丙沙星标准品,分别用0.03 mol/L氢氧化钠溶液助溶,用超纯水定容至100 mL,配置成100 μg/mL的标准储备液。
恩诺沙星注射液的配制:称取4 g的恩诺沙星原药,用少量氢氧化钠溶液助溶,用超纯水定容至100 mL,配置成40 mg/mL的标准储备液。
1.3 试验动物
试验所用克氏原螯虾来自湖北武汉克氏原螯虾某养殖基地,平均体质量(20.0±2.0) g,暂养于消毒后的水族箱中,试验用水为经过曝气的自来水,分别控制水温在(18±1) ℃和(25±1) ℃。试验前停食1 d,选择健康活泼的虾进行试验。
1.4 试验方法
1)色谱条件。色谱柱:Shodex Silica C18(250 mm ×4.6 μm,5 μm),流动相:0.05 mol/L磷酸溶液(用三乙胺调节pH值至2.4)/乙腈=86/14(V/V);流速:1.0 mL/min;紫外线检测波长:278 nm;柱温:40 ℃;进样量:20 μL。
2)给药与取样。正式给药前禁食1 d,给药前采集空白血淋巴及组织样品检测是否有药物残留。用100 μL微量注射器将恩诺沙星药液注射到克氏原螯虾围心窦,剂量为20 μg/kg(约10 μL)。于 0.083、0.25、0.5、0.75、1、2、4、6、8、12、24、36、48、72、120 h时间点采集血淋巴、肌肉、肝胰腺。每个时间点取6只螯虾。使用注射器从围心窦取血淋巴,并取肌肉、肝胰腺,样品保存于-80 ℃冰箱。
3)样品处理。冷冻保存的样品室温下自然解冻。吸取0.5 mL血淋巴于10 mL离心管中,加入7 mL的提取液(1 mol/L盐酸∶乙腈=4∶500,V/V),旋涡混合2 min,8 000 r/min 离心10 min,将上清液置于40 ℃恒温水浴氮气吹干。准确加入1 mL流动相,过0.22 μm滤膜,滤液用高效液相色谱仪检测。取1 g组织(肌肉、肝胰腺)匀浆,加入1 mL氯化钠溶液(1 mol/L)和1 mL PBS缓冲液,涡旋振荡2 min,加入4 mL酸化乙腈(1 mol/L盐酸∶乙腈=4∶500,V/V),涡旋混合2 min,4 ℃条件下8 000 r/min离心10 min。提取上清液移入另一离心管中,残留物加4 mL酸化乙腈充分涡旋震荡2 min,4 ℃下8 000 r/min离心10 min,提取上清液。合并上清液,取上清液于氮吹仪上40 ℃氮吹至干,用1 mL流动相溶解,2 mL正己烷去脂,取下清液用0.22 μm滤膜过滤,滤液用高效液相色谱检测药物含量。因为肝胰腺中脂肪含量较多,增加一次去脂步骤。
4)标准曲线。将标准工作液用超纯水分别稀释为0.01、0.05、0.1、0.5、1、5、10、20 μg/mL标准稀释液,取10 μL进样检测进行分析。以药物峰面积为纵坐标(Y),标准质量浓度C(μg/mL或μg/g)为横坐标(X)做标准曲线,计算回归方程及相关系数。
5)工作曲线。将克氏原螯虾中空白血淋巴或空白组织匀浆,加入已知浓度的标准溶液,制成含恩诺沙星和环丙沙星为0.01、0.05、0.1、0.5、1、5、10、20 μg/mL(μg/g)的血淋巴样品和组织样品。将各样品将按照本文“1.4”样品方法处理后,进行HPLC分析,求出工作曲线方程和相关系数。
6)回收率、精密度和检测限。取空白血淋巴和组织,分别添加100、10、1 μg/mL标准溶液100 μL,使各组织恩诺沙星、环丙沙星药物含量为10、1、0.1 μg,将各样品处理后,每个质量浓度重复测定3次,连续测定3 d,计算回收率和精密度。以引起3倍信噪比(S/N=3)的浓度为检测限。
2 结果与分析
2.1 色谱行为
恩诺沙星和环丙沙星出峰时间分别为9.529、13.351 min,目标药物峰形明显尖锐,基线平稳(图1)。本方法可以有效地分离恩诺沙星和环丙沙星,在样品中与其他色谱峰明显分离,无干扰峰(图2~4)。
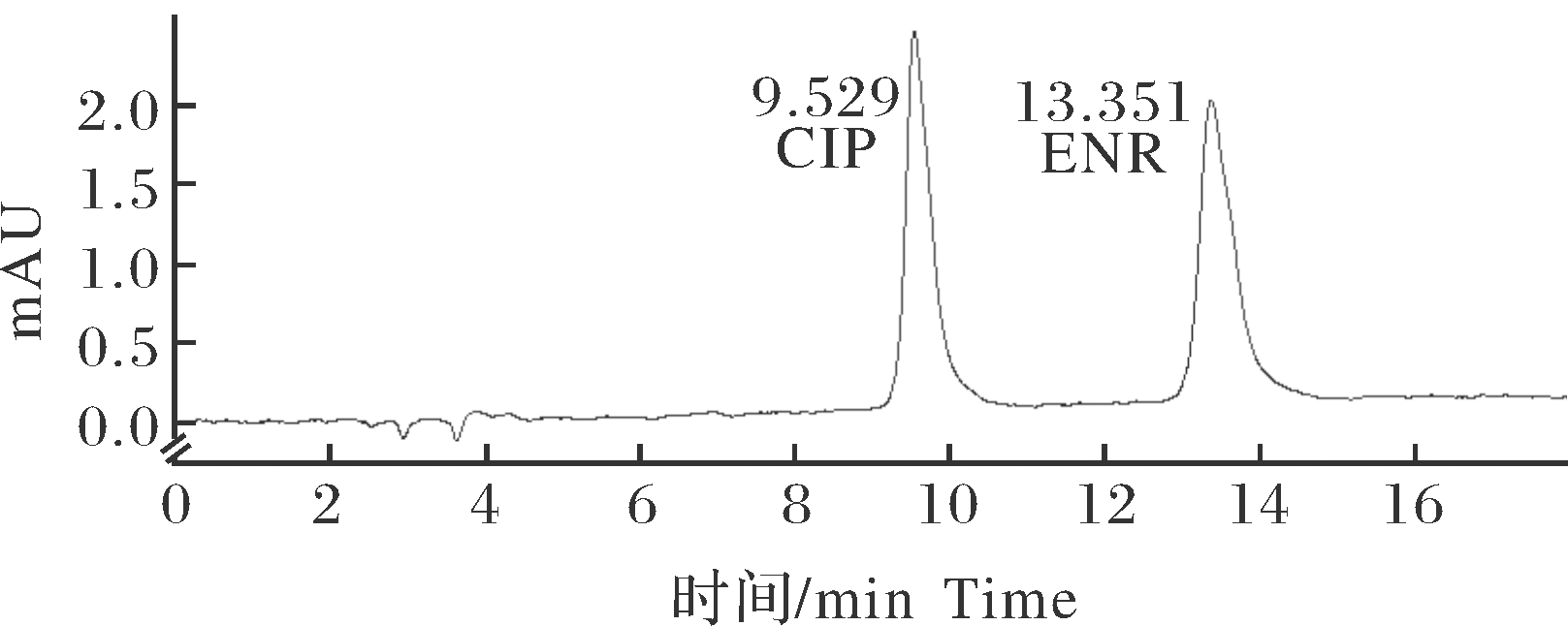
图1 恩诺沙星(ENR)和环丙沙星(CIP)标准溶液色谱图
Fig.1 Chromatograms of enrofloxacin and
ciprofloxacin standard solutions

图2 空白血淋巴色谱图与加标血淋巴色谱图
Fig.2 Blank hemolymph chromatogram and
spiked hemolymph chromatogram
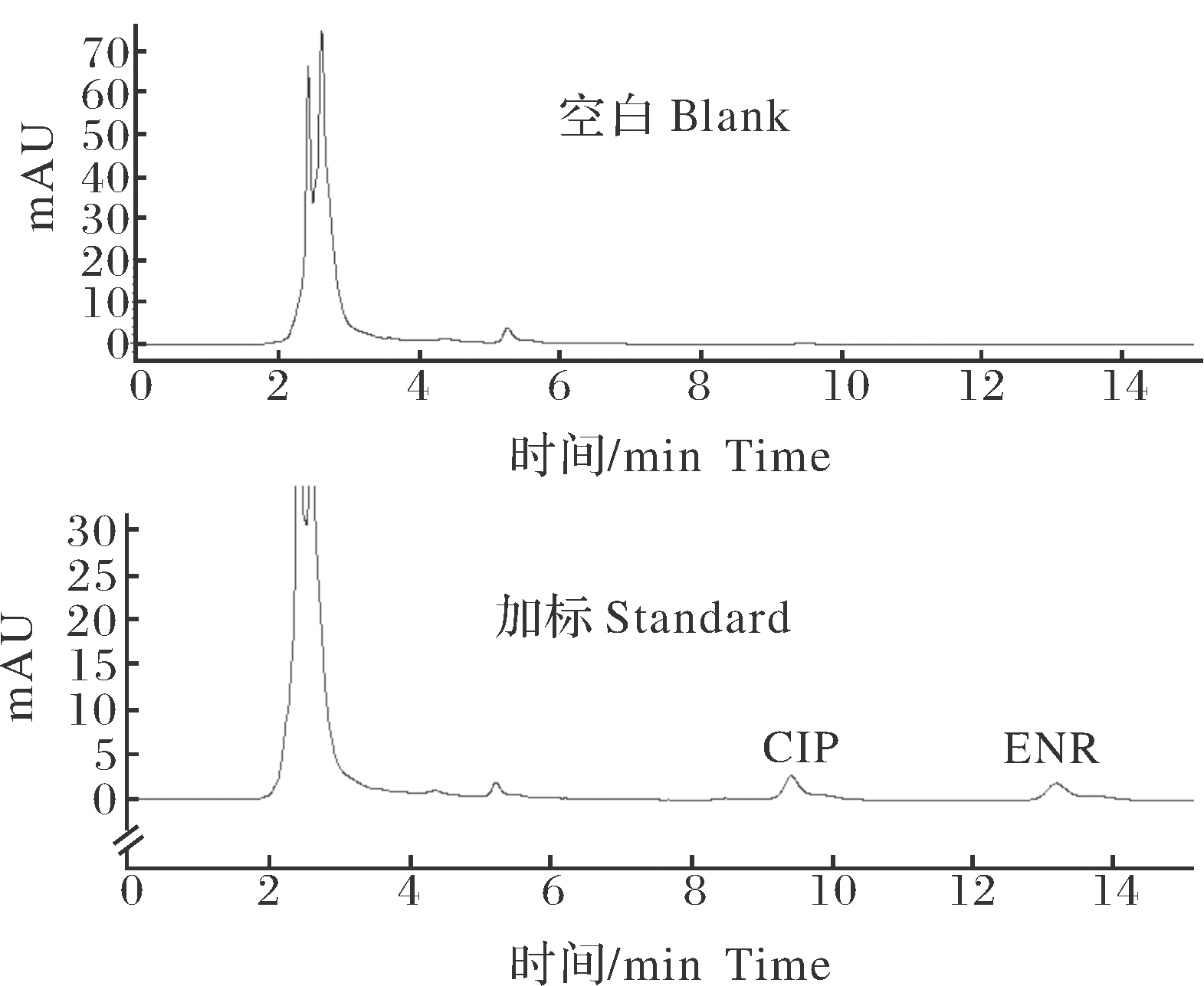
图3 空白肌肉色谱图与加标肌肉色谱图
Fig.3 Blank muscle chromatogram and
spiked muscle chromatogram
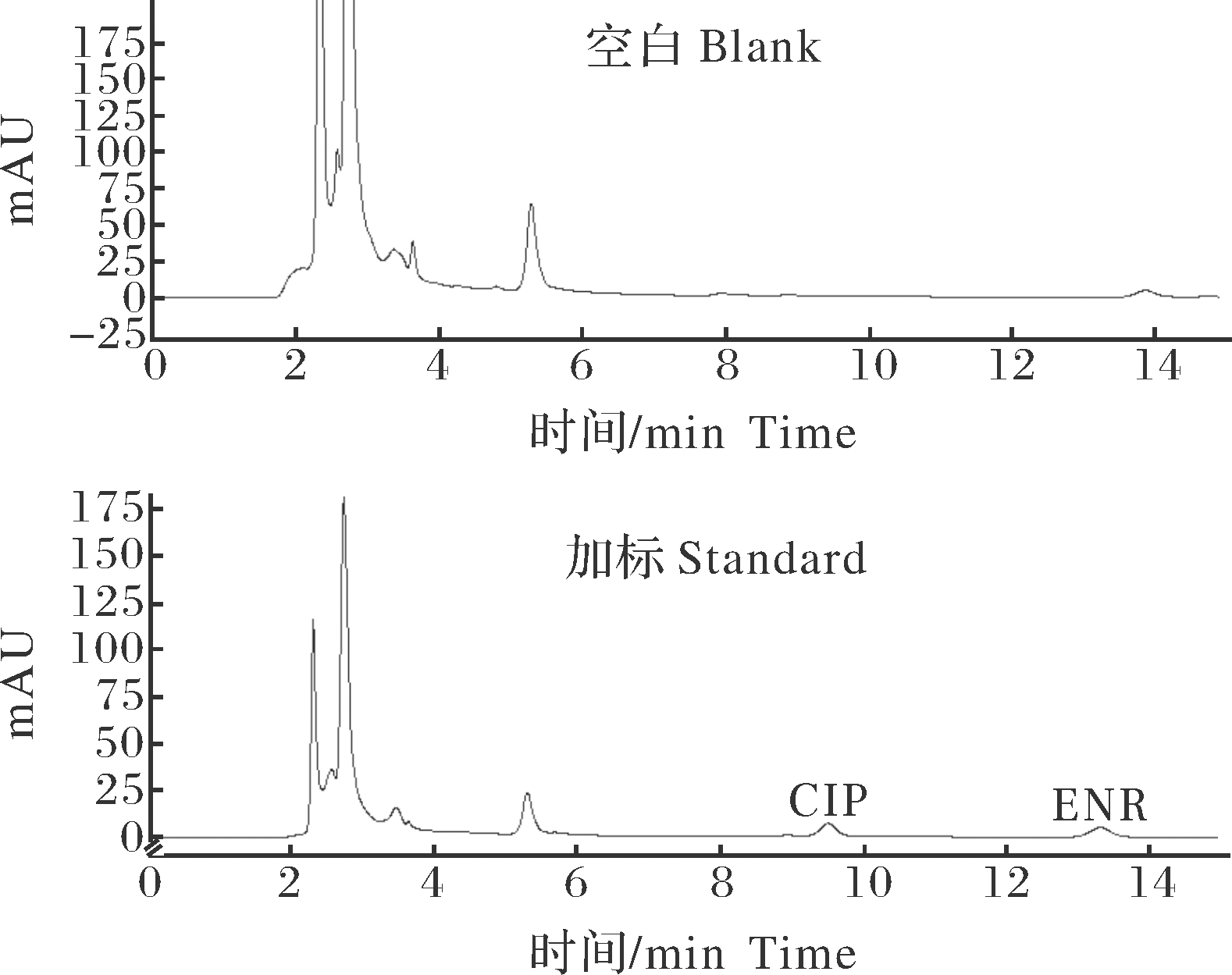
图4 空白肝胰脏色谱图与加标肝胰腺色谱图
Fig.4 Blank hepatopancreas chromatogram and
spiked hepatopancreas chromatogram
2.2 分析方法验证
恩诺沙星和环丙沙星的标准曲线方程分别为Y=61.618X-2.6977,Y=60.376X+0.1429,相关系数R2均大于0.99。恩诺沙星及环丙沙星在0.01~20 μg/mL质量浓度范围内线性关系良好(表1)。各组织中恩诺沙星和环丙沙星回收率均在80%~110%,说明回收率是在合理范围的(表2)。检测值日内变异系数均小于5%,日间变异系数均小于6%;检测限在0.003~0.008 μg/mL(μg/g),均低于欧盟(0.1 μg/mL 或μg/g)和日本(0.01 μg/mL或μg/g)规定的最高残留限量,表明本试验所用样品前处理和高效液相色谱检测方法具有较高的精确度。
表1 恩诺沙星和环丙沙星的工作曲线方程和相关系数
Table 1 ENR and CIP work composition line sum correlation number

组织Organization分析物Analyte回归方程Regression equation相关系数R2 Correlation coefficient血淋巴 HemolymphENRY= 52.733X-1.4870.999 8CIPY= 53.323X-4.195 0.999 1 肌肉 MuscleENRY= 66.322X-4.5020.998 5CIPY= 52.203X-5.015 0.997 0肝胰腺 HepatopancreasENRY= 33.673X+12.7150.993 3CIPY= 42.084X+13.9450.996 4
注 Note:1)ENR:恩诺沙星Enrofloxacin; 2)CIP:环丙沙星 Ciprofloxacin.下同。The same as below.
表2 恩诺沙星和环丙沙星的回收率、变异系数、检测限
Table 2 ENR and CIP-like recovery rate,variation number,limit of measurement
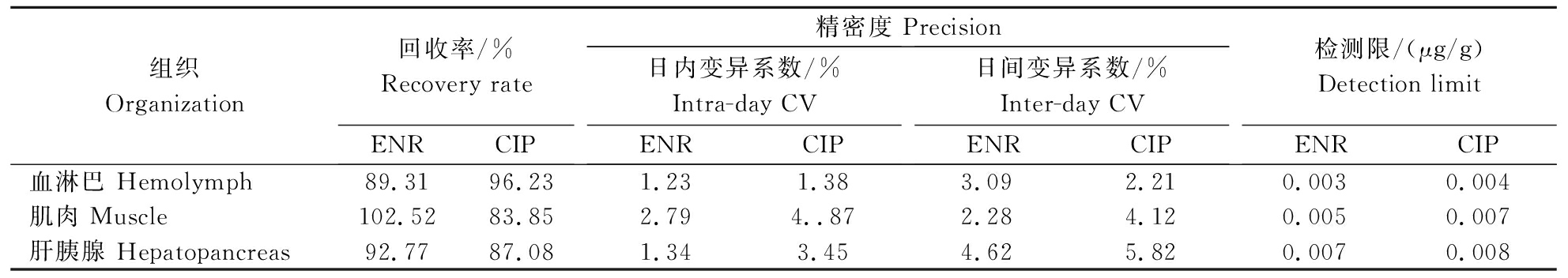
组织Organization回收率/%Recovery rateENRCIP精密度 Precision日内变异系数/% Intra-day CVENRCIP日间变异系数/%Inter-day CVENRCIP检测限/(μg/g)Detection limitENRCIP血淋巴 Hemolymph89.3196.231.231.383.092.210.0030.004肌肉 Muscle102.5283.852.794..872.284.120.0050.007肝胰腺 Hepatopancreas92.7787.081.343.454.625.820.0070.008
2.3 恩诺沙星和环丙沙星在克氏原螯虾体内的药-时变化规律
注射给药后,恩诺沙星在克氏原螯虾血淋巴的药时曲线见图5。由图5可见,恩诺沙星在18 ℃和25 ℃下在0.083 0 h达到峰值,分别为20.185 4 μg/mL和19.248 6 μg/mL,1~8 h恩诺沙星药物质量浓度呈快速下降趋势,8~120 h时药物质量浓度缓慢下降。18 ℃时环丙沙星在2 h达到第1个峰值(18 ℃为0.054 0 μg/mL),24 h时会出现第2个峰值(0.050 0 μg/mL);25 ℃时环丙沙星在2 h有1个峰值(0.072 6 μg/mL)。
注射给药后,恩诺沙星在克氏原螯虾肌肉中的药时曲线见图6。恩诺沙星在25 ℃(0.026 3 h)比18 ℃(0.344 7 h)更快达到峰值,随后出现缓慢下降,18 ℃时在6 h会出现第2个峰(9.848 5 μg/g)。18 ℃时,环丙沙星在0.75 h达到峰值(0.150 3 μg/g),在8 h时出现第2个峰(0.157 9 μg/g)。25 ℃时,环丙沙星在0.25 h达到峰值(0.733 9 μg/g),在4 h达到第2个峰,然后很快下降。
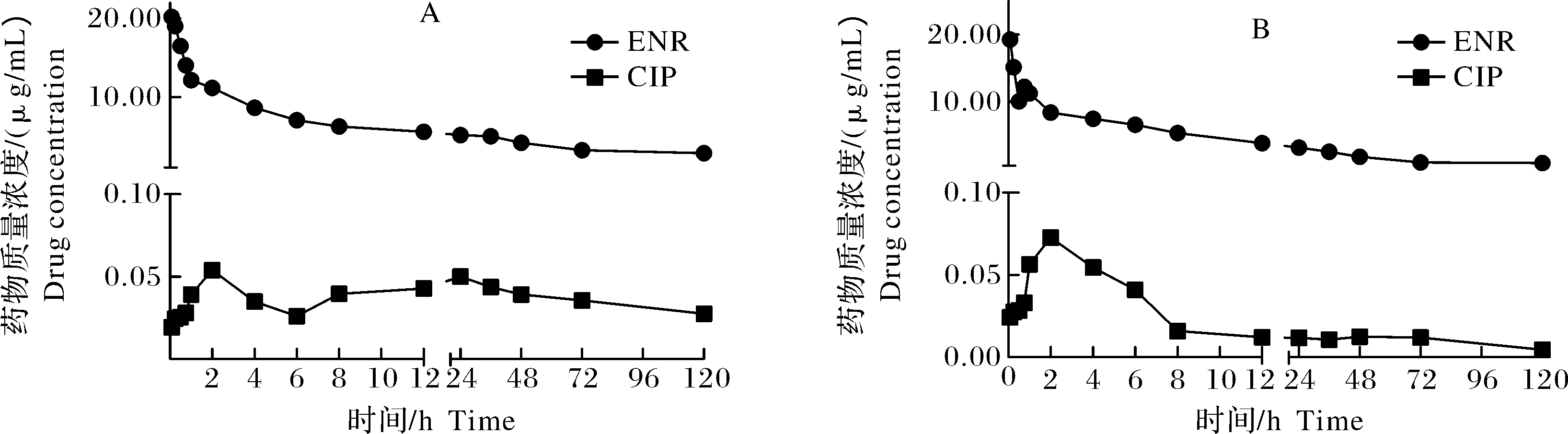
图5 18 ℃(A)和25 ℃(B)下单次注射后ENR和CIP在血淋巴中的药-时曲线(n=6)
Fig.5 Time-lapse curves of ENR and CIP in hemolymph after a single injection at 18 ℃ (A) and 25 ℃ (B) (n=6)

图6 18 ℃(A)和25 ℃(B)下单次注射后ENR和CIP在肌肉中的药-时曲线(n=6)
Fig.6 Time-lapse curves of ENR and CIP in muscle after a single injection at 18 ℃ (A) and 25 ℃ (B) (n=6)
单次注射给药后,恩诺沙星在克氏原螯虾肝胰腺中的药时曲线见图7。18 ℃时,恩诺沙星质量浓度在0~1 h时间段快速上升,4 h达到峰值,4~8 h出现快速下降;25 ℃时,恩诺沙星质量浓度在1 h达到峰值。18 ℃下环丙沙星分别在0.75、4 h达到峰值;25 ℃时,环丙沙星浓度在2 h达到峰值。

图7 18 ℃(A)和25 ℃(B)下单次注射后ENR和CIP在肝胰腺中的药-时曲线(n=6)
Fig.7 Time-lapse curves of ENR and CIP in Hepatopancreas after a single injection at 18 ℃ (A) and 25 ℃ (B) (n=6)
2.4 药代动力学特征
恩诺沙星在克氏原螯虾体内的药时数据用PK2.0软件和Graphpad Prism5软件进行拟合分析,结果显示,恩诺沙星在克氏原螯虾血淋巴中的药时数据符合二室开放模型,恩诺沙星在克氏原螯虾肌肉和肝胰腺中的药时数据符合一级吸收二室开放模型,其动力学参数见表3。环丙沙星在克氏原螯虾体内的药时数据为非房室模型,其主要动力学参数见表4。
表3 恩诺沙星在克氏原螯虾体内的药代动力学参数
Table 3 Pharmacokinetic parameters of enrofloxacin in Procambarus clarkii

参数Parameters血淋巴 Hemolymph18℃25℃肌肉 Muscle18℃25℃肝胰腺 Hepatopancreas18℃25℃A/(μg/mL)13.762 712.023 46.580 09.150 19.876 815.434 8α/(1/h)0.773 22.426 90.194 70.412 30.104 40.062 0B/(μg/mL)7.121 08.945 37.184 88.453 39.135 316.882 9β/(1/h)0.010 10.046 40.011 80.013 10.009 30.012 4Ka/(1/h)――14.681 216.860 11.893 24.114 8K10/(1/h)0.028 90.106 00.021 20.026 10.017 20.020 0K12/(1/h)0.484 11.305 30.077 40.192 10.040 20.015 9K21/(1/h)0.270 31.061 90.107 80.207 20.056 20.038 4Tmax/h0.083 00.083 00.344 70.263 41.933 51.165 8Cmax/(μg/mL or μg/g)20.185 419.248 613.221 316.425 016.555 530.731 3T1/2α/h0.896 50.297 33.559 61.681 16.641 111.174 5T1/2β/h68.552 718.608 758.914 452.743 774.622 155.740 3T1/2ka/h――0.047 20.041 10.366 10.168 4AUC(0-t)/((μg·h)/mL)514.306 2257.857 3494.711 3531.497 0745.454 91 293.194 5MRT/h140.859 057.000 680.925 973.751 899.974 370.802 4Vz/(L/kg)3.073 53.860 8――――CL/(L/(h·kg))0.021 90.065 50.027 20.028 00.011 20.012 6
注:A:分布相的零时截距;α:分布速率常数;B:消除相的零时截距;β:消除速率常数;Ka:药物吸收速率常数;K10:药物在中央室的消除速率;K12:药物自中央室到周边室的一级转运速率;K21:药物自周边室到中央室的一级转运速率;T1/2α:分布相半衰期;T1/2β:消除相半衰期;T1/2ka:吸收相半衰期;Vz:表观分布容积;CL:总体清除率;AUC(0-t): 0-t时的药时曲线下面积,Tmax:最大达峰时间,Cmax:药物最大达峰浓度;MRT:药物在体内的平均保留时间。Note:A:Zero-time intercept of the distribution phase; α:The distribution rate constant; B:The zero-time intercept of the elimination phase; β:The elimination rate constant; Ka:The rate of drug absorption rate; K12:The first-order transport rate of the drug from the central chamber to the peripheral chamber; K21:The first-order transport rate of the drug from the peripheral chamber to the central chamber; T1/2α:The distribution phase half-life; T1/2β:Elimination phase half-life; T1/2ka :The absorption phase half-life; Vz:Apparent distribution volume; CL:Total clearance; AUC(0-t):Area under the drug-time curve when 0-t; Tmax :The maximum peak time; Cmax:The maximum peak concentration of the drug; MRT:The average retention time of the drug in the body.
表4 环丙沙星在克氏原螯虾体内的药代动力学参数
Table 4 Pharmacokinetic parameters of ciprofloxacin in Procambarus clarkii
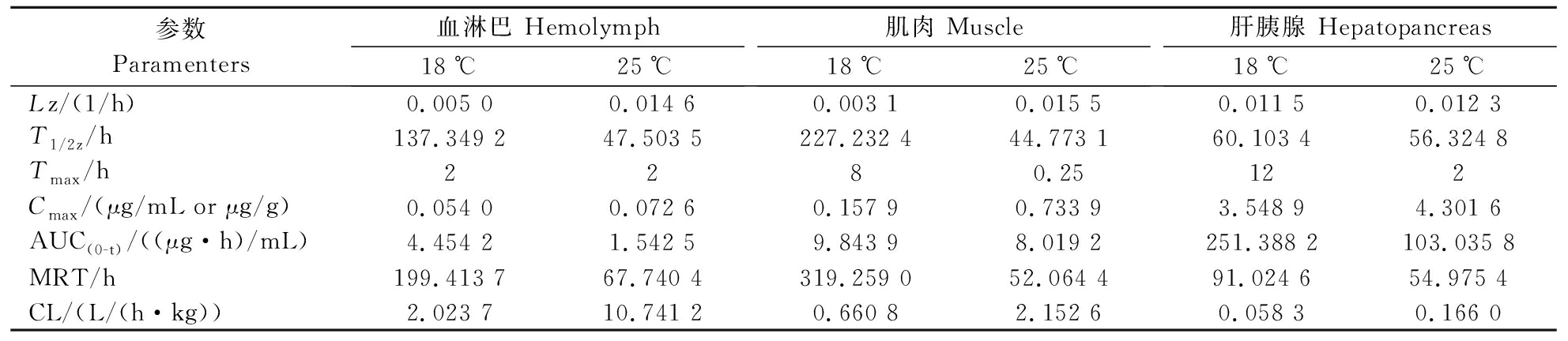
参数Paramenters血淋巴 Hemolymph18℃25℃肌肉 Muscle18℃25℃肝胰腺 Hepatopancreas18℃25℃Lz/(1/h)0.005 00.014 60.003 10.015 50.011 50.012 3T1/2z /h137.349 247.503 5227.232 444.773 160.103 456.324 8Tmax/h2280.25122Cmax/(μg/mL or μg/g)0.054 00.072 60.157 90.733 93.548 94.301 6AUC(0-t)/((μg·h)/mL)4.454 21.542 59.843 98.019 2251.388 2103.035 8MRT/h199.413 767.740 4319.259 052.064 491.024 654.975 4CL/(L/(h·kg))2.023 710.741 20.660 82.152 60.058 30.166 0
注:Lz:消除速率常数;T1/2z:消除半衰期。Note:Lz:The elimination rate constant; T1/2z:Elimination phase half-life.
3 讨 论
3.1 恩诺沙星在克氏原螯虾体内的药代动力学特征
恩诺沙星在克氏原螯虾血淋巴中的药时数据符合二室开放模型,在肌肉和肝胰腺中的药时数据符合一级吸收二室开放模型,这与恩诺沙星在三疣梭子蟹[10]、金鳟[11]、西伯利亚鲟[12]、中华绒螯蟹[13]中的结果相似。
本试验中,在18 ℃水温下,恩诺沙星在克氏原螯虾血淋巴、肌肉、肝胰腺中的Tmax分别为0.083 0、0.344 7、1.933 5 h,Cmax分别为20.185 4、13.221 3、16.555 5 μg/mL,在25 ℃水温下,恩诺沙星在克氏原螯虾血淋巴、肌肉、肝胰腺中的Tmax分别为0.083 0、0.263 4、1.165 8 h,Cmax分别为19.248 6、16.425 0、30.731 3 μg/mL,这说明温度较高时,恩诺沙星在克氏原螯虾体内达峰时间快。与不同温度下恩诺沙星在中华绒螯蟹中的达峰时间快和达峰浓度的规律一致[13]。
18 ℃水温下,恩诺沙星在克氏原螯虾血淋巴、肌肉、肝胰腺中的T1/2α分别为0.896 5、3.559 6、6.641 1 h,AUC(0-t)分别为514.306 2、494.711 3、745.454 9(μg·h)/mL;25 ℃时T1/2α分别为0.297 3、1.681 1、11.174 5 h,AUC(0-t)分别为257.857 3、531.497 0、1 293.194 5(μg·h)/mL。AUC越大,说明恩诺沙星在克氏原螯虾中分布越广泛,可以更好地起到杀菌作用。温度较高时,恩诺沙星在血淋巴、肌肉中的分布半衰期更短。在大菱鲆中,温度同样促进了分布半衰期的减少[7]。
消除半衰期T1/2β和清除率CL是药物在体内消除快慢的主要药动学参数[13]。18 ℃时恩诺沙星在克氏原螯虾血淋巴、肌肉、肝胰腺中的T1/2β分别为68.552 7、58.914 4、74.622 1 h,25 ℃时分别为18.608 7、52.743 7、55.740 3 h。18 ℃恩诺沙星在克氏原螯虾血淋巴、肌肉、肝胰腺中的CL分别为0.021 9、0.027 2、0.011 2 L/(h·kg),25 ℃时分别为0.065 5、0.028 0、0.012 6 L/(h·kg),温度提高,血淋巴、肌肉、肝胰腺中的恩诺沙星消除加快,这与有关的研究结果一致[14]。温度提高可以促进恩诺沙星在克氏原螯虾体内的分布和消除,但由于生物种类、给药剂量、养殖环境的不同,恩诺沙星代谢程度存在差异[15-17],与其他甲壳类动物[18]一样,克氏原螯虾拥有开放性循环系统,肝胰腺是药物吸收的主要器官,因此肝胰腺中药物浓度高、消除半衰期较长。
3.2 环丙沙星在克氏原螯虾体内的药代动力学特征
研究表明,恩诺沙星在水生动物体内大部分以原药形式存在,有一部分去乙基代谢转化为环丙沙星[19],因此研究恩诺沙星的代谢产物环丙沙星在体内的药代动力学同样具有重要意义。在本试验中,18 ℃时环丙沙星在克氏原螯虾血淋巴、肌肉、肝胰腺中的消除斜率常数分别为0.005 0、0.003 1、0.011 5 1/h,在肝胰腺中消除最快,其次是血淋巴、肌肉。25 ℃水温条件下环丙沙星在克氏原螯虾血淋巴、肌肉、肝胰腺中的消除斜率常数分别为0.014 6、0.015 5、0.012 3 1/h,在肌肉中消除最快,其次是血淋巴、肝胰腺。温度较高时,加快了各组织中环丙沙星的消除。除血淋巴外,肌肉和肝胰腺中的达峰时间在25 ℃ 时( 0.25 h、2 h)比18 ℃ (8 h、12 h)快,血淋巴、肌肉、肝胰腺在25 ℃时的清除率也比18 ℃快。试验中发现,环丙沙星的浓度比恩诺沙星的浓度要低得多,水温18 ℃和25 ℃下血淋巴中环丙沙星和恩诺沙星的AUC比值分别为0.8%和0.5%,这与大菱鲆(口灌)[7]和鲫(注射和口灌)[16]中的结果相似。肝胰腺中环丙沙星的比值要比血淋巴、肌肉中高,这种现象也存在于中华绒螯蟹中[13]。药物主要代谢产物所占的比例在一定程度上体现动物对该药的代谢强度[20],且与水温成正比[17]。试验中环丙沙星呈不规则衰减的方式,可能受恩诺沙星代谢的影响[21]。
3.3 休药期
由于恩诺沙星在克氏原螯虾的肝胰腺中代谢较慢,同时要不断转化为环丙沙星,因此把肝胰腺作为药物残留的靶器官。在2019年发布的《食品安全国家标准 食品中兽药最大残留限量》中,规定的最大残留限量为0.2 μg/g(恩诺沙星+环丙沙星)[18];日本则规定恩诺沙星最高残留限量为0.01 μg/g。以0.2 μg/g为残留标准,利用软件WT 1.4计算出本试验中25 ℃水温时恩诺沙星在肝胰腺达到残留标准需要311.470 0 h,18 ℃水温时恩诺沙星在肝胰腺达到残留标准为417.770 0 h。以0.01 μg/g为残留标准,利用软件WT 1.4计算出本试验中25 ℃时恩诺沙星在肝胰腺达到残留标准为490.640 0 h,18 ℃时恩诺沙星在肝胰腺达到残留标准为680.580 0 h。制定休药期不仅要考虑残留量,还要考虑水温等状况[22]。根据本试验结果,按照国家标准0.2 μg/g为残留标准,建议休药期为325 (℃·d)。以日本0.01 μg/g为残留标准,建议休药期为511 (℃·d)。
[1] 兰江风,代云佳,林蠡. 养殖克氏原螯虾体内白斑综合征病毒的绝对定量分析[J]. 水产学报,2016,40(3):318-325. LAN J F,DAI Y J,LIN L. Quantitative analysis of white spot syndrome virus in the tissues of cultured red swamp crayfish (Procambarus clarkii ) [J]. Journal of fisheries of China,2016,40(3):318-325 ( in Chinese with English abstract).
[2] ROCCA G D,SALVO A D,MALVISI J,et al. The disposition of enrofloxacin in seabream ( Sparus aurata L.) after single intravenous injection or from medicated feed administration[J]. Aquaculture,2004,232(1/2/3/4):53-62.
[3] 张英豪,顾泽茂,兰江风.虾应对感染的先天免疫反应研究进展[J]. 华中农业大学学报,2019,38(3):119-130.ZHANG Y H,GU Z M,LAN J F. Recent advances in study of immune response of shrimp to pathogen infection:a review[J]. Journal of Huazhong Agricultural University,2019,38(3):119-130 (in Chinese with English abstract).
[4] JIRAVANICHPAISAL P,ROOS S,EDSMAN L,et al. A highly virulent pathogen,Aeromonas hydrophila,from the freshwater crayfish Pacifastacus leniusculus[J]. Journal of invertebrate pathology,2009,101(1):56-66.
[5] ZHANG J B,WU G H,MENG Y,et al. Study on the pharmacokinetics of enrofloxacin in the Chinese mitten-handed crab, Eriocheir sinensis,after different administration regimes[J]. Aquaculture research,2008,39(11):1210-1215.
[6] FAN J,SHAN Q,WANG J,et al. Comparative pharmacokinetics of enrofloxacin in healthy and Aeromonas hydrophila-infected crucian carp (Carassius auratus gibelio) [J]. Journal of veterinary pharmacology & therapeutics,2017,40(5):580-582.
[7] LIANG J,JIAN L I,ZHAO F,et al. Pharmacokinetics and tissue behavior of enrofloxacin and its metabolite ciprofloxacin in turbot Scophthalmus maximus at two water temperatures[J]. Chinese journal of oceanology and limnology,2012,30(4):644-653.
[8] BOWSER P R,WOOSTER G A,STLEGER J,et al. Pharmacokinetics of enrofloxacin (Bayer) in rainbow trout Oncorhynchus mykiss[J]. Journal of veterinary pharmacology & therapeutics,1992,15(1):62-71.
[9] 周帅,胡琳琳,房文红,等. 恩诺沙星及其代谢产物环丙沙星在拟穴青蟹体内的药代动力学[J]. 水产学报,2011,35(8):1182-1190. ZHOU S,HU L L,FANG W H,et al. Pharmacokinetics of enrofloxacin and its metabolite ciprofloxacin in mud crab (Scylla paramamosain)[J]. Journal of fisheries of China,2011,35(8):1182-1190 ( in Chinese with English abstract).
[10] 余开,赵青松,陈寅儿,等. 恩诺沙星在三疣梭子蟹主要组织中的代谢动力学[J]. 生物学杂志,2011,28(4):25-29.YU K,ZHAO Q S,CHEN Y E,et al.Pharmacokinetics of enrofloxacin in main tissues Portunus trituberculatus [J]. Journal of biology,2011,28(4):25-29 ( in Chinese with English abstract).
[11] 司力娜,陈琛,李绍戊,等. 恩诺沙星在金鳟和哲罗鲑鱼体内的药代动力学比较[J]. 江苏农业科学,2011,39(6):390-392. SI L N,CHEN C,LI S W,et al.Comparison of the pharmacokinetics of enrofloxacin in golden trout and Jerome salmon[J]. Jiangsu agricultural sciences,2011,39(6):390-392(in Chinese).
[12] 赵凤,周洲,刘永涛,等. 恩诺沙星及其代谢物在西伯利亚鲟体内的药动学及消除规律[J]. 西南农业学报,2017,30(4):957-961. ZHAO F,ZHOU Z,LIU Y T,et al. Pharmacokinetics and elimination of enrofloxacin and ciprofloxacin (enrofloxacin metabolite) in Acipenser sibirica[J]. Southwest China journal of agricultural sciences,2017,30(4):957-961 ( in Chinese with English abstract).
[13] 张静波. 恩诺沙星在中华绒螯蟹体内的药物代谢动力学影响因素的研究[D]. 南京:南京农业大学,2008. ZHANG J B. The effect on the pharmacokjnetics of enrofloxacin in Chinese mitten-handed crab,Eriocheir sinensis[J]. Nanjing:Nanjing Agricultural University,2008 ( in Chinese with English abstract).
[14] HUANG Y Q,CHEN X X,WANG H,et al. Pharmacokinetics of florfenicol in blunt-snout bream (Megalobrama amblycephala) at two water temperatures with single-dose oral administration[J]. Journal of veterinary pharmacology and therapeutics,2019,42(5):564-571.
[15] 潘明轩,李兆新,邢丽红,等. 恩诺沙星及其代谢产物在南美白对虾体内药代动力学研究[J]. 食品安全质量检测学报,2018,9(6):1261-1267. PAN M X,LI Z X,XING L H,et al. Pharmacokinetics of enrofloxacin and its residue ciprofloxacin in Penaeus vannamei[J]. Journal of food safety and quality,2018,9(6):1261-1267 ( in Chinese with English abstract).
[16] SHAN Q,FAN J,WANG J,et al. Pharmacokinetics of enrofloxacin after oral,intramuscular and bath administration in crucian carp (Carassius auratus gibelio)[J]. Journal of veterinary pharmacology & therapeutics,2017,41(1):159-162.
[17] 艾晓辉,刘长征,周运涛. 不同水温和给药方式下磺胺甲噁唑在草鱼体内的药动学研究[J]. 水生生物学报,2005,29(2):99-103. AI X H,LIU C Z,ZHOU Y T. A study on pharmacokinetic of sulphamethoxazole in grass carp at different temperatures and administration regimes[J]. Acta hydrobiologica sinica,2005,29(2):99-103 ( in Chinese with English abstract).
[18] 中华人民共和国农业农村部. GB 31650-2019:食品安全国家标准食品中兽药最大残留限量[S]. 北京:中国农业出版社,2019. Ministry of Agriculture and Rural Affairs of the PRC.GB 31650—2019:National food safety standard maximum residue limits for veterinary drugs in foods[S].Beijing:China Agriculture Press,2019 (in Chinese).
[19] KIRBY A,LEWBART G A,HANCOCK-RONEMUS A,et al. Pharmacokinetics of enrofloxacin and ciprofloxacin in Atlantic horseshoe crabs (Limulus polyphemus) after single injection[J]. Journal of veterinary pharmacology & therapeutics,2017,41(2):349-353.
[20] 岳刚毅,吴志新,杨倩,等. 氟苯尼考及氟苯尼考胺在克氏原螯虾体内药物代谢动力学[J]. 水生生物学报,2011,35(2):307-312. YUE G Y,WU Z X,YANG Q,et al. Pharmacokinetics of florfenicol and its metabolite,florfenicol amine,in red swamp crayfish,Procambarus clarkii[J]. Acta hydrobiologica sinica,2011,35(2):307-312 ( in Chinese with English abstract).
[21] 赵海军,欧安,简纪常,等. 恩诺沙星在凡纳滨对虾体内的代谢和残留消除规律[J]. 广东海洋大学学报,2010,30(6):35-38. ZHAO H J,OU A,JIAN J C,et al. Elimination of enrofloxacin residues and its metabolism in Penaeus vannamei[J]. Journal of Guangdong Ocean University,2010,30(6):35-38 (in Chinese with English abstract).
[22] 杨秋红,艾晓辉,刘永涛,等. 不同温度下恩诺沙星及其代谢物在斑点叉尾鮰各组织中的残留及消除规律比较[J]. 水生生物学报,2017,41(4):781-786. YANG Q H,AI X H,LIU Y T,et al. Studies on elimination dynamics of enroflixacin residues and its metabolites Channel actfish at two different water temperatures[J]. Acta hydrobiologica sinica,2017,41(4):781-786 ( in Chinese with English abstract).