克氏原螯虾(Procambarus clarkii)俗称小龙虾,原产于北美洲,1929年自日本传入中国,现已成为我国水产养殖的重要养殖品种之一。近年来,伴随着养殖规模的不断扩大和养殖密度的增加,克氏原螯虾产业发展也遇到了问题和挑战,如野生资源下降导致的种质退化、养殖模式标准化程度低、病害频发等问题[1]。克氏原螯虾传染性疾病具有暴发特征,通常会导致大量死亡甚至绝产,成为克氏原螯虾健康养殖的主要威胁[2]。
摩氏摩根菌(Morganella morganii)是一种广泛存在于自然界中的条件性致病菌,能感染动物和人,是一种人兽共患病原菌[3-4]。该菌呈短杆状,革兰氏染色阴性,在水产养殖中能导致多动水产动物如中华鳖(Pelodiscus sinensis)、大鲵(Andrias davidianus)、乌鳢(Channa argus)、胡子鲶(Claris fuscus)等出现内脏充血出血、肌肉充血和皮肤出血溃烂等症状,严重者甚至出现大量死亡[5-8]。笔者从患病克氏原螯虾肝胰腺内分离到1株能导致克氏原螯虾大量死亡的病原菌。笔者对该分离株进行了分离鉴定,并检测分析了该菌对常见抗菌药物的敏感性以及抗菌药物与天然化合物的联合抑菌作用,旨在为克氏原螯虾“五月瘟”病原分析和疾病防控提供依据。
1 材料与方法
1.1 试验材料
患病克氏原螯虾从湖北省潜江市某养殖场采集;攻毒用健康虾由笔者所在实验室临床试验基地提供;药敏纸片购自杭州微生物试剂有限公司;脑心浸液培养基、MH培养基购自青岛海博生物有限公司;天然化合物购自四川维克奇公司;PCR Master Mix、细菌基因组提取试剂盒等分子生物学试剂购自南京诺唯赞公司。
1.2 细菌分离和纯化
取患病克氏原螯虾,在无菌工作台中用无菌生理盐水冲洗体表3~5次后剖取其肝胰腺。肝胰腺经无菌生理盐水冲洗后在匀浆器中匀浆,取匀浆液在脑心浸液(BHI)固体培养基上划线,28 ℃培养箱中静置培养16~20 h。从长好细菌的平板挑取单菌落继续划线2~3次对细菌进行纯化,纯化好的细菌标记为QJ20190513,并制备甘油菌保存于-80 ℃。
1.3 回归感染试验
QJ20190513分离株单菌落在BHI液体培养基培养至对数生长中期后采用麦氏比浊法将菌液浓度调整至1.5×108、1.5×107、1.5×106、1.5×105和1.5×104 cfu/mL 5个不同的浓度梯度。将180尾试验用健康克氏原螯虾随机分为6组,试验组分别在第2腹节和第3腹节处注射制备好的菌悬液100 μL,注射无菌生理盐水的健康虾作为阴性对照组。感染后的虾暂养于玻璃缸内,水温保持23~25 ℃,溶解氧5.5~5.7 mg/mL。感染后观察8 d,记录各组临床症状和死亡数。将濒死虾的肝胰腺参照本文“1.2”方法进行病原分离,并进行鉴定。试验结束后采用Bliss法计算该菌株对健康克氏原螯虾的半致死浓度(LC50)[9]。
1.4 生理生化鉴定
首先取单菌落进行革兰氏染色后镜检,观察分离株的形态特征。此外,采用API20E生化鉴定试剂条进行生化鉴定。参照试剂条说明书,从平板上挑取菌落用无菌生理盐水稀释至合适浓度后加入试剂条各个孔中,在28 ℃条件下继续培养24 h后判定结果。
1.5 细菌分子鉴定
参照试剂盒说明书提取QJ20190513分离株的全基因组,以其为模板通过PCR的方法扩增分离株16S rRNA片段,PCR上游引物(16S rRNA-F):5′-AGAGTTTGATCATGGCTC-3′,下游引物(16S rRNA-R):5′-TACGGTTACCTTGTTACGACTT-3′。扩增后得到的PCR产物经1%琼脂糖凝胶电泳鉴定后取目的条带进行凝胶回收并测序。将测序结果用Blast软件分析同源性并采用MEGA5.1软件以邻接法构建进化树,校正模型为Kimura 2-parameter,通过Bootstraps法自举数集1 000次。
1.6 药敏试验
从BHI平板上挑取QJ20190513分离株的单菌落至BHI液体培养基中,28 ℃培养至对数生长中期,离心收集菌体。菌体经无菌生理盐水洗涤3次后采用麦氏比浊法将菌液浓度调整为1.5×108 cfu/mL。用无菌玻璃棒将菌液均匀涂布于MH琼脂培养基上,然后将药敏纸片贴于平板上,28 ℃培养箱中继续培养16~18 h后测定抑菌圈直径,判定该菌对不同药物的敏感性。
1.7 联合抑菌试验
采用棋盘法研究多西环素和10种不同天然化合物联合后对QJ20190513分离株的联合抑菌作用[10]。将药物分别用MH肉汤在离心管中倍比稀释,分别取50 μL恩诺沙星和天然化合物加入到96孔细胞培养板中,使多西环素浓度从第2孔到第10孔(从左到右)依次降低,天然化合物浓度从B到H孔(从上到下)依次降低。培养至对数生长中期的菌液经离心和无菌生理盐水反复冲洗后,采用麦氏比浊法调整至浓度为5×106 cfu/mL,取100 μL稀释好的菌液加入到96孔板中,混合均匀后置于28 ℃培养箱中继续培养16~18 h,分别设置阴性和阳性对照。记录多西环素与天然化合物单独使用的最小抑菌浓度(MIC)和联合使用以后各自的MIC。联合抑菌作用采用抑菌浓度指数FICI评价,计算公式如下:ICI=MICA药联合/MICA药单独+MICB药联合/MICB药单独。协同作用 (synergism,SYN;FICI≤0.5);无关作用 (indifference,IND;0.5
2 结果与分析
2.1 分离株的培养特性
从患病克氏原螯虾肝胰腺纯化的优势菌在BHI固体培养基上形成白色半透明的光滑菌落,革兰氏染色后经显微镜镜检发现该菌株为革兰氏阴性短杆状细菌。
2.2 分离株对克氏原螯虾的毒力
将QJ20190513分离株以注射方式感染健康的克氏原螯虾,发现感染后的克氏原螯虾出现了活力下降等症状,且感染虾出现了不同程度的死亡,死亡率与感染剂量呈正相关,在感染试验过程中阴性对照组未出现发病和死亡情况(表1)。进一步剖检发现,感染后的克氏原螯虾肝胰腺发白甚至水肿,肌肉发白。此外,从症状明显的感染虾肝胰腺中分离到了1株优势菌,其培养特性与分离株QJ20190513基本一致。经Bliss法计算得到该菌株对克氏原螯虾的半数致死浓度LC50为2.8×105 cfu/mL。
表1 QJ20190513菌株感染健康克氏原螯虾后的死亡率
Table 1 Mortality of the QJ20190513 isolate on healthy crayfish
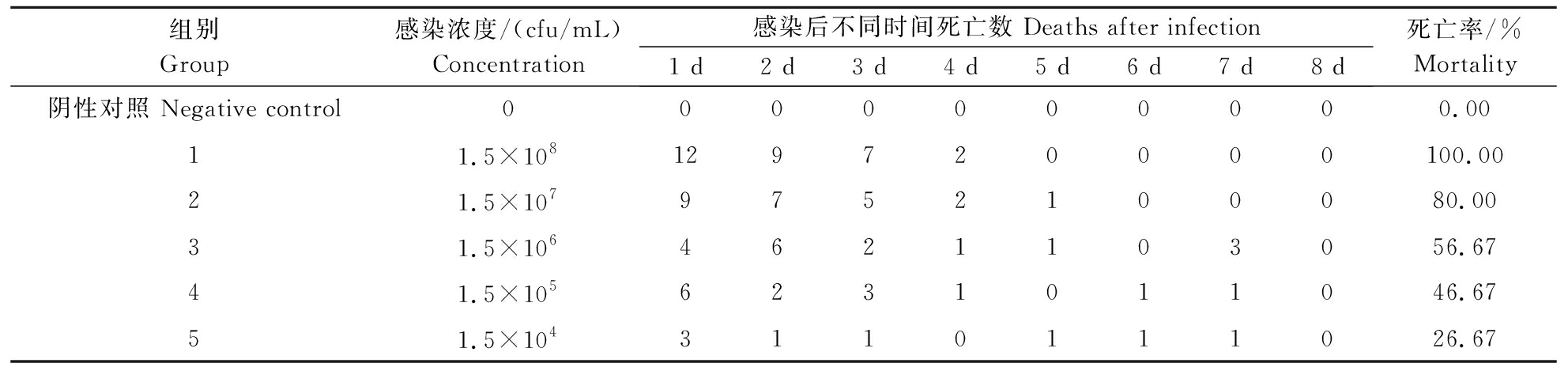
组别Group感染浓度/(cfu/mL)Concentration感染后不同时间死亡数 Deaths after infection1 d2 d3 d4 d5 d6 d 7 d 8 d死亡率/%Mortality阴性对照 Negative control0000000000.0011.5×108129720000100.0021.5×1079752100080.0031.5×1064621103056.6741.5×1056231011046.6751.5×1043110111026.67
2.3 生化鉴定结果
采用API20E细菌鉴定试纸条和ATB细菌鉴定系统分析了分离株QJ20190513的生化特征,结果如表2所示。经ATB系统判定该菌株的生化特征与系统中摩氏摩根菌的特征相符合,其相似度为99.9%。
表2 分离株QJ20190513的生化特征
Table 2 Biochemical characterization of the QJ20190513 isolate
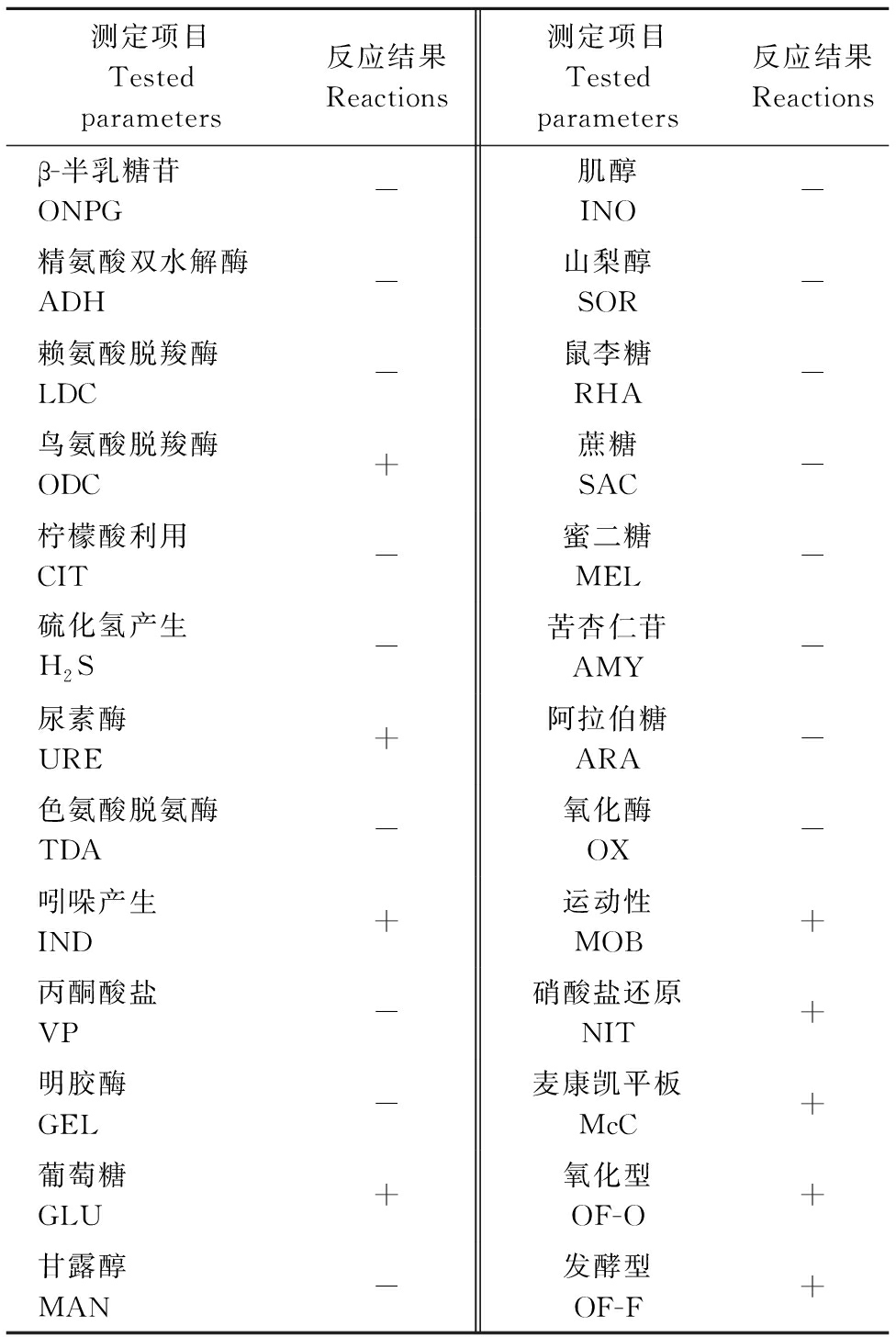
测定项目Testedparameters反应结果Reactions测定项目Testedparameters反应结果Reactionsβ-半乳糖苷ONPG-肌醇INO-精氨酸双水解酶ADH-山梨醇SOR-赖氨酸脱羧酶LDC-鼠李糖RHA-鸟氨酸脱羧酶ODC+蔗糖SAC-柠檬酸利用CIT-蜜二糖MEL-硫化氢产生H2S-苦杏仁苷AMY-尿素酶URE+阿拉伯糖ARA-色氨酸脱氨酶TDA-氧化酶OX-吲哚产生IND+运动性MOB+丙酮酸盐VP-硝酸盐还原NIT+明胶酶GEL-麦康凯平板McC+葡萄糖GLU+氧化型OF-O+甘露醇MAN-发酵型OF-F+
2.4 分子生物学鉴定
通过PCR方法得到了分离株QJ20190513的16S rRNA片段,其长度约为1.5 kb。将测序结果提交至Blast软件与GenBank中已知序列比对发现,该菌株与摩氏摩根菌的同源性大于99%。通过MEGA软件构建发育树(图1)发现,分离株QJ20190513(MT890001)与摩氏摩根菌(AY464464.1)亲缘关系较近,结合该菌株的生理生化特征将QJ20190513菌株鉴定为摩氏摩根菌。

图1 QJ20190513菌株的系统发育树
Fig.1 Phylogenetic tree based on 16S rRNA
genes sequence of QJ20190513
2.5 药物敏感性
采用K-B法检测了QJ20190513分离株对20种化学药物的敏感性,结果发现,分离株对妥布霉素、新霉素、亚胺培南等7种药物敏感,对卡那霉素中度敏感,对庆大霉素、链霉素、头孢唑啉等12种药物耐药(表3)。
2.6 协同抑菌试验
从表3可见,QJ20190513菌株对多西环素不敏感,多西环素对QJ20190513菌株的最小抑菌浓度为64 μg/mL(表4)。受试天然化合物血根碱、和厚朴酚、二氢辣椒碱和异土木香内酯对菌株 QJ20190513的生长均有一定的抑制作用,其MIC分别为16、64、32和64 μg/mL (表4)。而当多西环素与天然化合物联合使用后仅二氢辣椒碱与多西环素具有协同抑制QJ20190513菌株的作用,其FICI为0.19,联合使用后多西环素MIC下降了16倍,二氢辣椒碱MIC下降了8倍。
表3 QJ20190513分离株对20种抗菌药物敏感性
Table 3 Antibiotic susceptibility of QJ20190513 strain to 20 kinds of antibiotics
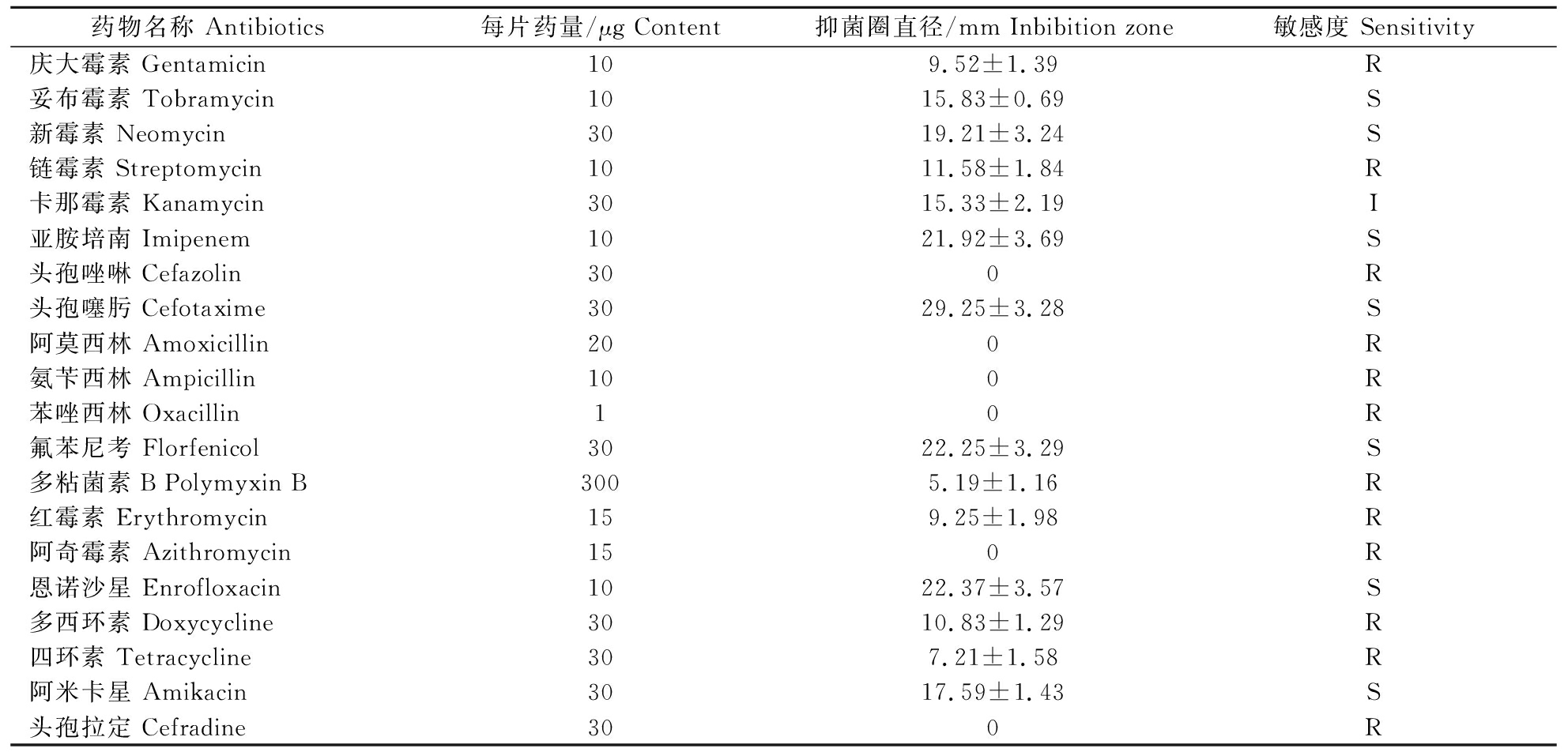
药物名称 Antibiotics每片药量/μg Content抑菌圈直径/mm Inbibition zone 敏感度 Sensitivity庆大霉素 Gentamicin109.52±1.39R妥布霉素 Tobramycin1015.83±0.69S新霉素 Neomycin3019.21±3.24S链霉素 Streptomycin1011.58±1.84R卡那霉素 Kanamycin3015.33±2.19I亚胺培南 Imipenem1021.92±3.69S头孢唑啉 Cefazolin300R头孢噻肟 Cefotaxime3029.25±3.28S阿莫西林 Amoxicillin200R氨苄西林 Ampicillin100R苯唑西林 Oxacillin10R氟苯尼考 Florfenicol3022.25±3.29S多粘菌素B Polymyxin B3005.19±1.16R红霉素 Erythromycin159.25±1.98R阿奇霉素 Azithromycin150R恩诺沙星 Enrofloxacin1022.37±3.57S多西环素 Doxycycline3010.83±1.29R四环素 Tetracycline307.21±1.58R阿米卡星 Amikacin3017.59±1.43S头孢拉定 Cefradine300R
注:S:敏感;I:中度敏感;R:耐药。Note:S:Susceptible; I:Intermediate; R:Resistant.
表4 天然化合物与多西环素(单独或联合)对QJ20190513菌株的最小抑菌浓度
Table 4 The MIC values of natural products and doxycycline (alone or combination) against QJ20190513 strain
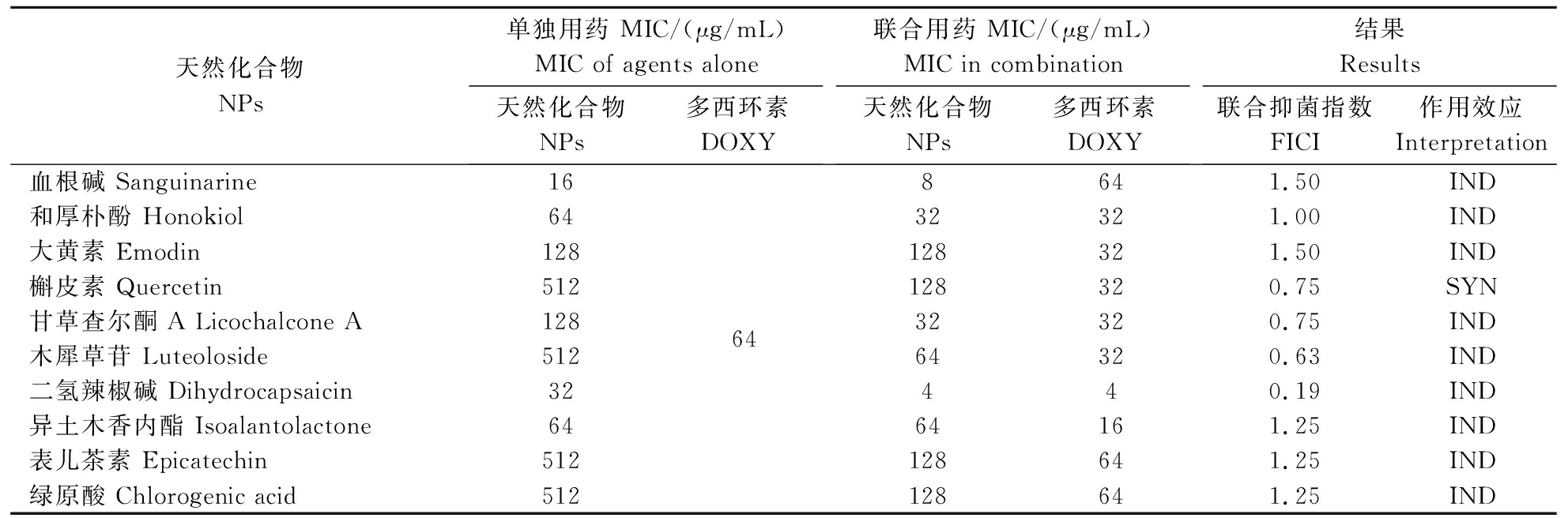
天然化合物NPs单独用药 MIC/(μg/mL)MIC of agents alone天然化合物NPs多西环素DOXY联合用药 MIC/(μg/mL)MIC in combination天然化合物NPs多西环素DOXY结果Results联合抑菌指数FICI作用效应Interpretation血根碱 Sanguinarine16648641.50 IND和厚朴酚 Honokiol 6432321.00 IND大黄素 Emodin128128321.50 IND槲皮素 Quercetin512128320.75 SYN甘草查尔酮A Licochalcone A12832320.75 IND木犀草苷 Luteoloside51264320.63 IND二氢辣椒碱 Dihydrocapsaicin32440.19 IND异土木香内酯 Isoalantolactone6464161.25 IND表儿茶素 Epicatechin512128641.25 IND绿原酸 Chlorogenic acid512128641.25 IND
3 讨 论
克氏原螯虾对环境适应能力较强,可在低氧、多种水温和水质环境差的地方生存,是近年来具有较高经济价值的养殖品种之一[11]。然而近年来由于克氏原螯虾养殖面积和养殖密度的不断增加,导致克氏原螯虾的感染性疾病的报道也越来越多,如白斑综合征病毒、弗氏柠檬酸杆菌、维氏气单胞菌、副溶血弧菌和螺旋体等[11-14]。本试验首次发现摩氏摩根菌能够导致克氏原螯虾发病和大规模死亡,通过回归试验发现该菌株对健康克氏原螯虾具有较强的致病力,在感染后导致大量感染虾的快速死亡。此外,人工感染的克氏原螯虾表现出与天然发病虾类似的症状,如活动力下降、应激能力差、肝胰腺发白、肌肉弹性下降和颜色变浅等。克氏原螯虾与其他甲壳类动物类似,缺乏脊椎动物的获得性免疫力,其抵御病原体主要依靠先天免疫系统[15]。因此,研究病原体对克氏原螯虾的致病规律对于减少发病具有重要意义。
摩氏摩根菌是人类肠道中的正常菌群之一,通常不会导致人类疾病,但在特殊条件下能导致免疫力低下的人发生感染,在人类医学上是一种少见的条件性致病菌[16]。摩氏摩根菌能导致多种不同动物发病,包括陆生动物和多种水生动物。陆小萏等[17]从患病的锦鲤(Cyprinus carpio Linnae)中分离到1株摩氏摩根菌,经人工感染发现其对健康锦鲤具有较强的致病力,该研究首次发现摩氏摩根菌能够感染鱼类。近年来,水产养殖动物感染摩氏摩根菌的报道越来越多,乌鳢、中华鳖、胡子鲶、鲈(Lateolabrax japonicas)、大鲵等均能在天然条件下感染摩氏摩根菌并引起发病和死亡[6-8,18]。尽管目前尚无摩氏摩根菌通过水产动物感染人的报道,但水产食品作为人类的主要蛋白质来源之一,极易通过水产品加工、未煮熟的水产食品或发生污染的水域将病原菌扩散到人类,从而导致严重的公共卫生问题。因此,加强对水产动物摩氏摩根菌感染的防控不仅有利于降低水产养殖业因感染造成的损失,对于保障水产动物性食品安全和人类健康也具有重要意义。但目前尚未阐明摩氏摩根菌导致水产动物感染的机制,因此迫切需要深入研究以控制摩氏摩根菌在水产养殖领域的感染。
化学抗菌药物是目前防治水产养殖动物细菌性疾病的主要手段,但药物的长期不合理使用导致了病原菌耐药性的产生,给细菌性病害防控带来了困难。研究发现,不同来源的摩氏摩根菌对抗菌药物有不同程度的耐药,如氨基糖苷类、酰胺醇类、β-内酰胺类等[19]。本试验分离的摩氏摩根菌对受试的7种药物高度敏感,1种药物中等敏感,12种药物耐药;与以往的研究有一定差异,分析其原因可能与各地区不同养殖品种的用药习惯及菌株来源有关。QJ20190513菌株对水产养殖用兽药新霉素、恩诺沙星和氟苯尼考高度敏感,但对多西环素耐药,因此选取了多西环素筛选能与其有协同抑菌的天然化合物。结果发现,受试天然化合物如血根碱等单独使用时即表现出一定程度的抑菌作用,但仅多西环素与二氢辣椒碱联用后其FICI<0.5,具有协同抑菌作用。协同抑菌作用能提高药物的敏感性,延长药物的使用寿命,对于耐药性摩氏摩根菌的防控具有重要意义。
[1] 舒新亚.克氏原螯虾产业发展及存在的问题[J].中国水产,2010(8):22-25.SHU X Y.Problems of industrial development of Procambarus clarkii [J].China fisheries,2010(8):22-25(in Chinese).
[2] 罗亚平,刘小燕,谭进.克氏原螯虾疾病研究进展[J].科学养鱼,2019(3):44-46.LUO Y P,LIU X Y,TAN J.Research progress of crayfish disease[J].Scientific fish farming,2019(3):44-46 (in Chinese).
[3] ZHAO C,TANG N,WU Y,et al.First reported fatal Morganella morganii infections in chickens[J].Vet Microbiol,2012,156(3/4):452-455.
[4] GOLUBIC-CEPULIC B,BUDIMIR A,PLECKO V,et al.Morganella morganii causing fatal sepsis in a platelet recipient and also isolated from a donor's stool[J].Transfusion medicine,2004,14(3):237-240.
[5] 陈永亮,高晓华,李怡,等.鳖源摩氏摩根菌分离鉴定及药敏特性分析[J].南方农业学报,2015,46(11):2046-2052.CHEN Y L,GAO X H,LI Y,et al.Isolation,identification and antibiotic sensitivity test of Morganella morganii from Trionyx sinens [J].Journal of southern agriculture,2015,46(11):2046-2052 (in Chinese with English abstract).
[6] 韦阳道,易弋,黎娅,等.胡子鲶致病性摩氏摩根菌的分离鉴定与致病性研究[J].中国畜牧兽医,2017,44(1):221-226.WEI Y D,YI G,LI Y,et al.Isolation,identification and pathogenicity analysis of Morganella morganii in Clarias fuscus[J].China animal husbandry & veterinary medicine,2017,44(1):221-226 (in Chinese with English abstract).
[7] 李瑞伟,曾令兵,张辉,等.患病大鲵摩氏摩根菌的分离与鉴定[J].畜牧与兽医,2014,46(1):28-32.LI R W,ZENG L B,ZHANG H,et al.Isolation and identification of Morganella morganii from diseased Giant salamanders[J].Animal husbandry & veterinary medicine,2014,46(1):28-32 (in Chinese with English abstract).
[8] 杨移斌,宋怿,杨秋红,等.乌鳢(Channa argus)源摩氏摩根菌(Morganella morganii)的分离、鉴定及药敏特性[J].浙江农业学报,2018,30(2):194-202.YANG Y B,SONG Y,YANG Q H,et al.Isolation,identification and antibiotic sensitivity of Morganella morganii from Channa argus [J].Acta agriculturae Zhejiangensis,2018,30(2):194-202 (in Chinese with English abstract).
[9] FINNEY D J.The median lethal dose and its estimation[J].Arch Toxicol,1985,56(4):215-218.
[10] ODDS F C.Synergy,antagonism,and what the chequerboard puts between them[J/OL].J Antimicrob Chemother,2003,52(1):1.[2020-08-06].https://doi.org/10.1093/jac/dkg301.
[11] LIU X D,HE X,AN Z H,et al.Citrobacter freundii infection in red swamp crayfish (Procambarus clarkii) and host immune-related gene expression profiles[J/OL].Aquaculture,2020,515:734499.https://www.sciencedirect.com/science/article/pii/S0044848619309330.DOI:10.1016/j.aquaculture.2019.734499.
[12] 彭博文,杨移斌,艾晓辉,等.克氏原螯虾源维氏气单胞菌分离鉴定及药敏特性研究[J].海洋湖沼通报,2018(4):108-114.PENG B W,YANG Y B,AI X H,et al.Isolation and identification of Aeromonas veronii from Procambarus clarkii and its antibiotic sensitivity [J].Transactions of oceanology and limnology,2018(4):108-114 (in Chinese with English abstract).
[13] 陈一铭,顾泽茂,李莉娟,等.白斑综合征病毒感染对克氏原螯虾肠道菌群的影响 [J].华中农业大学学报,2020,39(2):40-45.CHEN Y M,GU Z M,LI L J,et al.White spot syndrome virus (WSSV) infection impacts intestinal microbiota composition in Procambarus clarkii [J].Journal of Huazhong Agricultural University,2020,39(2):40-45 (in Chinese with English abstract).
[14] BAUMGARTNER W A,HAWKE J P,BOWLES K,et al.Primary diagnosis and surveillance of white spot syndrome virus in wild and farmed crawfish (Procambarus clarkii,P.zonangulus) in Louisiana,USA[J].Diseases of aquatic organisms,2009,85(1):15-22.
[15] 张英豪,顾泽茂,兰江风.虾应对感染的先天免疫反应研究进展[J].华中农业大学学报,2019,38(3):119-130.ZHANG Y H,GU Z M,LAN J F.Recent advances in study of immune response of shrimp to pathogen infection:a review[J].Journal of Huazhong Agricultural University,2019,38(3):119-130 (in Chinese with English abstract).
[16] 马晓波,吕晓菊,母丽媛,等.临床分离91株摩氏摩根菌的药敏分析[J].中国抗生素杂志,2006(8):501-504.MA X B,LÜ X J,MU L Y,et al.Antimicrobial susceptibility analysis of ninety-one clinical isolates of Morganella morganii [J].Chinese journal of antibiotics,2006(8):501-504 (in Chinese with English abstract).
[17] 陆小萏,邹为民,谭爱萍,等.锦鲤摩氏摩根氏菌的鉴定及致病性研究[J].淡水渔业,2005(2):3-5.CHEN X D,ZOU W M,TAN A P,et al.Identification and pathogenicity of Morganella morganii in Cyprinus carpio Linnae [J].Freshwater fisheries,2005(2):3-5 (in Chinese).
[18] 李雪峰,王利.鲈鱼摩氏摩根菌的鉴定及药敏试验[J].动物医学进展,2015,36(2):65-68.LI X F,WANG L.Identification and drug senstivity test of Morganella morganii isolated from Lateolabrax japonicas[J].Progress in veterinary medicine,2015,36(2):65-68 (in Chinese with English abstract).
[19] 孔蕾,朱凝瑜,贝亦江,等.中华鳖(Pelodiscus sinensis)摩氏摩根菌(Morganella morganii)的鉴定及致病性研究[J].海洋与湖沼,2013,44(3):722-727.KONG L,ZHU N Y,BEI Y J,et al.Isolation and identification of pathogenic Morganella morganii isolates from Chinese soft-shelled turtle Pelodiscus sinensis [J].Oceanologia et limnologia sinica,2013,44(3):722-727(in Chinese with English abstract).