柑橘黄龙病(citrus Huanglongbing)或青果病(citrus greening disease)是柑橘生产上最具破坏力的病害之一,在全球范围内造成了重大的经济损失[1]。早在20世纪,国内外科学家针对黄龙病病原体的演化过程开展了相关研究,最初的研究认为黄龙病是由水害引起[2],直到林孔湘的嫁接试验认为其是由病毒感染所致[3]。1979年柯冲使用电子显微镜观察到类立克次体(RLO)[4],1994年Jagoueix等[5]对黄龙病病原的非洲株系和亚洲株系的16S rDNA 基因进行测序比对分析后,才最终确认黄龙病病原为革兰氏阴性细菌。病原体Candidatus liberibacter因只在柑橘韧皮部中生存,所以称之为韧皮部限制性细菌,通过带病苗木和媒介木虱Diaphorina citri ( Kuwayama)、Trioza erytreae(Del Guerci)、 Cacopsylla citrisuga (Yang & Li) 传播蔓延,属于α-变形菌纲,包括3个暂定种,分别是亚洲种‘Ca. L. asiaticus’(CLas),非洲种‘Ca.L. africanus’(CLaf),美洲种‘Ca.L. americanus’(CLam)[1,6]。
现有的商业化柑橘品种均易被黄龙病菌感染[7],病症在幼苗期主要表现为植株矮小化、抽梢困难、叶片斑驳黄化;成熟期则表现为黄梢、果皮绿化、果肉苦涩,严重影响商业价值[1]。通常在病发后的几年内黄化枯萎,给果农带来巨大经济损失。由于黄龙病症状的复杂性,通过症状表型来诊断黄龙病较为困难。尽管高灵敏度qPCR技术可用于疑似患病柑橘的诊断,但繁琐的样品准备过程、高昂的检测成本、依赖训练有素的检验人员以及诊断后柑橘树被挖除造成的经济损失等,都促使研究人员开发新型快速简便的黄龙病菌诊断技术和高效防控策略。
“三板斧”被认为是目前最有效的黄龙病防控策略,即选用无病苗木、及时挖除病株、大面积连片防治木虱。但是在实际的防控过程中,“三板斧”仍然存在以下问题:(1)大规模挖除病株造成了巨大的经济损失;(2)木虱成虫易感染CLas且繁殖能力极强,同时,由于受到“感染柑橘”物理因素和化学因素的诱导[8],要实现对木虱迁徙和繁殖的完全控制存在许多困难;(3)农药的长期使用诱导了耐药性木虱的产生[9-10]。而从目前黄龙病防控效果来看,“三板斧”策略虽可有效地控制和预防黄龙病规模性传播,但是无法彻底解除黄龙病的潜在威胁。
针对CLas基因组的研究结果表明,该菌基因组相对较小,缺少某些细菌生长发育所必需的持家基因,同时也缺乏合成多种氨基酸的能力,不能还原硫酸盐,这可能是CLas限于韧皮部位生长和难于在体外培养的原因[11];模拟韧皮部环境体外培养CLas也未能完成科赫氏法则验证,极大地阻碍了黄龙病菌防治药物的研发速度和进程[12-13]。基于上述原因,包括抗生素药物、窄谱靶向药物、免疫诱导制剂、纳米制剂在内的多类抗菌剂受到广泛关注。
抗生素具有抗菌生理活性,可在短期内降低柑橘树体内的CLas浓度,控制黄龙病的病情[14-15],是当前治疗黄龙病最有效的化学药物。窄谱高效的小分子靶向药物不易引起细菌耐药性,安全性高,但CLas无法体外纯培养,导致靶向小分子药物的筛选只能依赖于CLas的模式亲缘细菌,其研究进展也慢于常规农作物病害药物的筛选[16-18]。此外,小分子柑橘免疫诱导物(例如ROS等)可激活柑橘自身的免疫系统和抗性蛋白基因抵抗病原菌的感染,被认为是目前化学药物控制黄龙病的综合措施之一[19-20]。而利用纳米技术的独特优势在改善抗菌剂溶解浓度、植物传质和新型抗菌金属制剂等方面也有极大的应用前景,是当前农业病害保护领域最具前景的研究领域,或可取代当前锌、铜制剂作为有效的抗菌农用药剂抑制果园黄龙病的病情[20-23]。
1 抗生素疗法
抗生素对细菌感染的植物有着极强的疗效,在40多种抗生素当中,农业领域商业化使用的抗生素只有10种,包括中国、美国、墨西哥、欧洲、中东等地都曾使用抗生素对抗植物细菌性病原,其中仅有链霉素和四环素被广泛应用在苹果、番茄、梨树等农作物疾病的治理[24-25]。早在20世纪70年代,人们对黄龙病发病原因还未完全探明之前,抗生素就已经被证明具有治疗黄龙病的作用[1]。围绕盐酸四环素防控黄龙病,我国开展了相关研究,随着黄龙病病原菌的发现,包括中国、印度、南非在内的许多国家和地区都开始使用四环素来治疗黄龙病,通过无病接穗培育无病苗,进一步抑制果园黄龙病病情[26-27]。然而,四环素只是一种抑菌剂,在使用过程中,仍需对柑橘树重复治疗,且四环素的反复使用对柑橘树产生了较大的生理毒性,限制了其在果园中的广泛使用。
研究者们围绕抗生素药物抗黄龙病开展了系列研究。在抗菌活性和生理毒性研究方面,将感染黄龙病的柑橘接穗用抗生素浸泡1~2 h后,嫁接至健康的柑橘砧木上生长4~6个月,根据砧木上黄龙病菌的浓度、柑橘生长情况,将处理结果分成高效组、低效组、无效组3组(表1)。结果表明,青霉素、盐酸土霉素、磺胺类抗生素处理后黄龙病菌浓度均低于qPCR的检测阈值,柑橘接穗生长速率、存活率与对照组相当[15];除此之外,目前采用树干注射青霉素、磺胺二甲氧嘧啶钠、盐酸土霉素制剂治疗黄龙病的效果也表明这3类抗生素是当前最有效的治疗药物[14,28-29]。围绕如何减小抗生素的使用量和增强黄龙病治疗效果,科研人员开展了抗生素混合制剂的研究。例如,单独使用链霉素不能达到抑制CLas的效果[14],但混合盐酸土霉素后注射染病的甜橙树,治疗后症状的恢复度明显优于单独使用盐酸土霉素[14];类似的研究结果也表明青霉素和链霉素的联合使用增强了青霉素抑制CLas的效率[30-31]。由于抗生素抑制黄龙病的效果本质上依赖于药物被柑橘吸收、转运至细菌生长部位的效率,因此,抗生素在柑橘内部吸收和传质的动力学行为,作为改善抗生素治疗黄龙病的重要方面,受到研究者的极大重视。我国早期黄龙病的研究表明,土壤肥料中加入抗生素的方式对黄龙病无治疗效果;传统叶面喷施受到蜡质层的限制使抗生素传质效率低下,而注射法相对于叶面喷洒法,可以直接将抗生素分子递送至木质部,并分配至植物的各个器官。例如,树干注射的土霉素从注射点转运至茎、叶等各器官组织中。据测算,即使是在不利于茎下传质的根部,土霉素浓度都足以抑制CLas[32];改进的输液滴干法使用青霉素和四环素也减轻了叶片黄化症状 [33]。
如表2所示,抗生素治疗黄龙病的研究虽然取得了显著的成效,可以作为无病接穗的处理药物,但由于药剂传质至韧皮部和根部的效率差以及CLas分布不均一等原因,导致抗生素无论在根、茎、叶等部位均未能完全杀灭病菌,尤其是根部CLas更是难以彻底清除,致使抗生素治疗后病情易反复。药剂混配、传质方式改变等策略为解决当前抗生素生物利用效率低、传质效率差等问题提供了新的思路。
表1 抗生素对黄龙病菌的抗菌活性和对柑橘的生理毒性[15]
Table 1 Activity of antibiotics against huanglongbing pathogen and their physiological toxicity to citrus reference[15]

抗生素Antibiotics质量浓度/(mg/L)Mass concentration溶剂Solvent活性和生理毒性Activity and physiological toxicity放线菌酮 Actidione25水 Water较大的毒性 High toxicity盐酸土霉素 Oxytetracycline hydrochloride100水 Water较大的毒性 High toxicity硫酸链霉素 Streptomycin sulfate100水 Water无效 No effect多粘菌素硫酸盐 B Polymixin B sulfate300水 Water无效 No effect西诺沙星 Cinoxacin300N,N-二甲基甲酰胺N, N-Dimethylformamide无效 No effect春雷霉素盐酸盐 Kasugamycin hydrochloride100水Water无效 No effect妥布霉素 Tobramycin20水 Water无效 No effect盐酸林可霉素 Lincomycinhydrocloride100 水Water无效 No effect硫酸新霉素 Neomycin hydrate trisulfate50水 Water无效 No effect硫酸阿米卡星 Amikacin sulfate100水 Water无效 No effect硫酸庆大霉素 Gentamicin sulfate100水Water无效 No effect井冈霉素 Validoxylamine A100水 Water部分治疗 Part effect中生菌素 Zhongshengmycin100水 Water部分治疗 Part effect潮霉素 B Hygromycin B150水 Water部分治疗 Part effect硫酸卡那霉素 Kanamycin sulfate100水 Water部分治疗 Part effect盐酸大观霉素 Spectinomycindihydrochloride pentadrate20水 Water部分治疗 Part effect盐酸万古霉素 Vancomycin hydrochloride40水 Water部分治疗 Part effect环丝氨酸 Cycloserine50水 Water部分治疗 Part effect利福霉素钠盐 Rifamycin sodium50水 Water部分治疗 Part effect利福昔明 Rifaximin50乙醇 Ethanol部分治疗 Part effect粘菌素 Colistinmethanesulfonate sodium20水 Water部分治疗 Part effect环丙沙星盐酸盐 Ciprofloxacin hydrochloride300水 Water部分治疗 Part effect磺胺甲噁唑 Sulfamethoxazole100水 Water部分治疗 Part effect磺胺噻唑钠盐 Sulfathiazole sodium100水 Water部分治疗 Part effect氯霉素 Chloramphenicol30水 Water部分治疗 Part effect利福霉素 Rifampicin50水 Water有效治疗 High effect磺胺甲氧嘧啶钠盐 Sulfadumethoxine sodium100水 Water有效治疗 High effect氨苄西林钠盐 Ampicillin sodium100水 Water有效治疗 High effect羧苄青霉素二钠盐 Carbenicillin disodium100水 Water有效治疗 High effect青霉素G钾盐 Penicillin G potassium100水 Water有效治疗 High effect头孢氨苄 Cefalexin100水 Water有效治疗 High effect
表2 抗生素对柑橘黄龙病治疗效果的试验评估
Table 2 Evaluation of the effection of antibiotics on citrus Huanglongbing

抗生素Antibiotics使用方式Useage method试验结论Test conclusion参考文献Reference青霉素,磺胺噻唑钠或链霉素Penicillin,sulfathiazole sodium or streptomycin叶面喷洒/注射染病树干Foliar spraying/injectionof infected tree trunks青霉素在田间表现出有效的黄龙病菌防治效果 Penicillin showed an effective control effect on Huanglongbing in the field[23]土霉素 Oxytetracycline注射染病树干Injection of infectedtree trunks减小韧皮部蛋白2的表达,抑制淀粉和蛋白对韧皮部的阻塞;增加注射点可增强吸收率,注射可增大有效浓度 Expression of phloem protein 2 was decreased,and the blockage of starch and protein on phloem was inhibited; the absorption rate was en-hanced by increasing injection point,and the effective concentration was increased by in-jection[29,32]
续表2 Continued Table 2

抗生素Antibiotics使用方式Useage method试验结论Test conclusion参考文献Reference阿莫西林、利福平和头孢氨苄Amoxicillin, rifampicin and cefalexin叶面喷洒/注射染病树干Foliar spraying/injection of infected tree trunks混配使用在提升疗效的同时增加了果实的产出和甜度、抗氧化等性能 Mixed use can improve the curative effect and increase the fruit yield, sweetness and antioxidant properties[30]阿莫西林和庆大霉素Amoxicillin and gentamicin浸泡染病枝条Soaking infected scion微生物多样性下降,CLas检测呈阴性Microbial diversity decreased, and CLas was negative[31]阿莫西林 Amoxicillin叶面喷洒纳米乳剂Foliar spraying of nano emulsion乳剂增强了柑橘叶片吸收的效率 The emulsion enhanced the absorption effi-ciency in citrus leaves[34]
2 窄谱靶向药物
寻找高效黄龙病菌靶向药物,是当前柑橘黄龙病综合防控研究的一个热点。鉴于CLas难于离体纯培养的特性,目前药物的靶标设计主要依赖于CLas亲缘菌,包括Sinorhizobium meliloti和Liberibacter crescens BT-1等模式菌型均被用于CLas基因功能研究和小分子靶向药物活性的初步体外鉴定[11-12]。黄龙病菌靶向药物研究虽然开展多年,但仍缺乏可以用于治疗和标记示踪的靶向小分子药物。本文依据黄龙病菌的靶向药物研究历程进行梳理,为后续的相关研究提供借鉴和指导。
2.1 靶标:ABC转运系统
靶标蛋白原则上要求具有重要的生理功能,例如,细菌分泌的毒力因子、基因表达所必需的转录调控因子、应激酶等,药物分子在与靶标结合后要达到抑制细菌生长和影响浸染活性的效果。而CLas具有唯一确定的ABC运输分泌系统,在细菌浸染植物的过程中会释放分泌蛋白,包括外分泌毒素因子和细菌信号分子。这些蛋白与细菌的有效感染密切相关,因此,分泌相关蛋白可以作为黄龙病治疗中一类重要的潜在药物靶标[35]。SecA是存在于CLas细胞膜上的外分泌蛋白转运酶,可与SecY、SecE等相互作用,介导着CLas外分泌蛋白的菌体外分泌[36-37]。因此,缺乏SecA会导致细菌功能和感染能力的紊乱。Akula等[36-37]基于SecA的结构特征,通过分子结合的方法设计了能够结合SecA蛋白ATP活性结构域的小分子药物 (图1, 1~5)。体外试验表明,这5种小分子药物对Agrobacterium tumefaciens展示出较强的抗菌能力。
2.2 靶标:转录调控因子
CLas的基因转录调节系统较为简单,LdtR、PrbP单一转录调节因子活性变化会影响到整个基因组的转录,这使得它们可以作为潜在的药物靶标[16,35,38]。基因CLIBASIA_01510的编码蛋白PrbP与黄龙病病菌致病机制、细菌感染能力以及环境胁迫抵抗力有关[38],托芬那酸(图2-1)作为PrbP配体,可破坏PrbP-RNAP和PrbP-DNA的相互作用,进而破坏开放复合物形成,影响细菌的转录水平[38]。试验表明,托芬那酸根部浸泡和叶面喷雾剂处理黄龙病病苗,可抑制70%细菌。治疗效果显示,染病幼苗根部可被快速治疗,因此,托芬那酸是极具潜力的黄龙病治疗药物[38]。转录调控因子LdtR,被认为是细菌感受环境变化的传感器,可以感受糖水平的变化,降解植物免疫化合物,影响细菌耐药性。植物韧皮部渗透压变化幅度较大,而感受渗透压变化对细菌在韧皮部的生长极为重要。研究发现,在CLas中LdtR有感受和调节细胞渗透压的能力,而LdtR对CLas在韧皮部的生存能力有着较大的影响[39]。同时,LdtR对LdtP的启动子还有高亲合性,能够结合并激活LdtP基因的转录,起到调节细胞壁肽聚糖修饰的功能,影响细胞壁合成及细菌响应渗透压变化[39]。利用靶向化学药物对体外Sinorhizobium meliloti和Liberibacter crescens BT-1进行筛选,发现根皮素(Phloretin)和苯溴马隆(Benzbromarone)(图2-2,2-3)可以结合LdtRLcr和LdtRSmc,抑制L. crescens和S. meliloti的生长,导致细菌形态萎缩,减弱细菌耐高渗透压的能力。与对照组相比,根皮素和苯溴马隆显著降低了LdtRCLas的活性,影响了细菌的形态,显示出潜在的黄龙病治疗效果[39];进一步的研究表明,苯溴马隆处理的模式细菌样本,其RNA转录本中252个基因表达程度发生了变化(CLas同源基因182个),其中LdtRCLas具有调控基因表达的功能,影响生理代谢过程,主要包括转录调节、细胞壁合成、能量代谢、细胞运动等[17]。
2.3 其他靶点
YbeY具有RNA核酸内切酶活性,失活后会导致细菌感染、环境响应、糖类化合物利用能力的下降,所以YbeY被认为是目前治疗黄龙病最有效的潜在靶点。Zuo等[18]通过基因组比对分析发现CLIBASIA_01560基因与大肠杆菌YbeY基因存在着42%的序列同源性,体外试验证实YbeYCLas具有16S rRNA 3’和5’内切酶活性;采用靶点口袋结合的方法筛选到小分子药物木犀草素(Luteolin)(图2-4)。研究表明,在感染黄龙病菌的植株中,木犀草素可有效抑制YbeY的RNA酶活性,干扰CLas的生理活动活性,因此,可作为潜在黄龙病的靶向药物。

图1 SecA靶点治疗小分子药物
Fig.1 SecA targets small molecule drugs
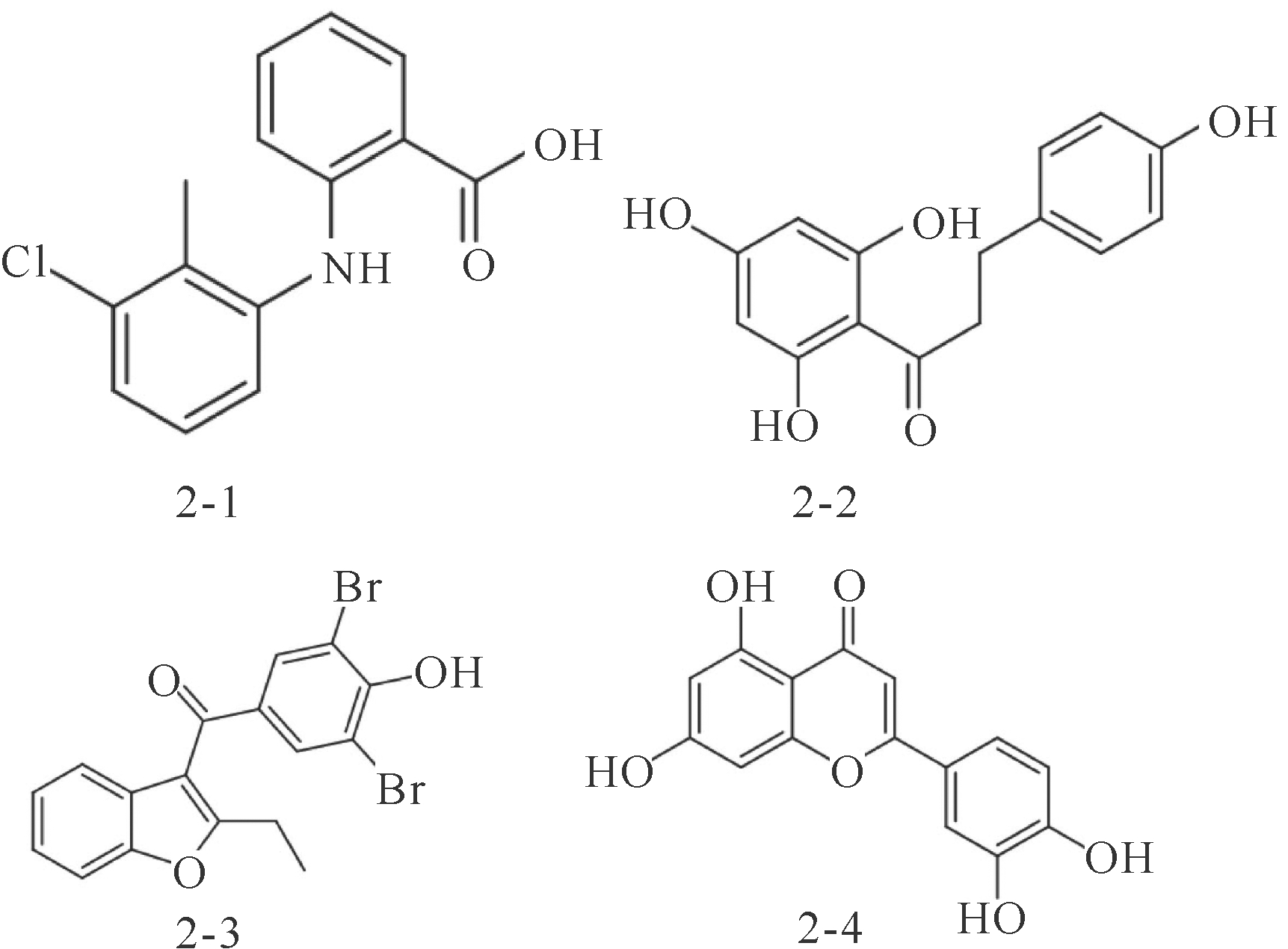
图2 黄龙病病菌PrbP、LdtR、YbeY靶点治疗化合物
Fig.2 Prbp,LDTR,YbeY target therapeutic compounds of Huanglongbing
3 免疫诱导治疗
系统性获得抗性(system acquired resistance,SAR)是植物受外来病原体入侵而诱导的抗性机制,涉及到特殊的防御信号转导途径,是植物重要的主动防御机制。当病原体感染植株或使用植物诱导物后,植株在全株表现出系统性的抗性。水杨酸SA(salicylic acid)和水杨酸甲酯是柑橘SAR途径的重要信号传递分子,参与植物的抗病调控。柑橘受到CLas感染后,水杨酸甲酯的表达水平明显上升,在叶绿体水杨酸甲基转移酶的作用下,MeSA转化为SA,并诱导转录因子结合物还原并进入细胞核,结合转录调节因子提升病原体相关蛋白(pathogenesis-related protein,PR)的表达,行使自我免疫功能[40-41]。但SA诱导的免疫在抵抗黄龙病菌时有一定的缺陷,CLas、Clam、CLaf测序表明,黄龙病菌含有潜在的水杨酸羟基化酶基因 (CLIBASIA_00255)[35,42-43],能够合成水杨酸羟基化酶,将SA和其天然代谢变体转化为活性较低的羟基水杨酸[44],SA的降解致使免疫途径受阻,PR蛋白的转录水平大幅度下降,这不仅降低了柑橘树对外来病原体的抗性,同时还降低了对外源SA的感受能力[44]。
研究发现,使用低分子质量的化学制剂可代替SA,起到同样的效果。通常这些免疫诱导物具有以下特征:(1)自身不具有杀菌能力;(2)能够激活植物SAR免疫途径;(3)对细菌的抑制酶不敏感[20]。在柑橘溃疡病治疗中发现,免疫诱导物吡虫啉、苯并噻二唑、2,6-二氯异烟肼、β-氨基丁酸等可激活柑橘SAR,大幅度提升PR-2基因的表达,抑制致病菌Xanthomonas citris ssp.对柑橘树的感染[45-47]。Palmer等[20]根据SA结构,设计的结构类似物在拟南芥叶片中同样增强了PR蛋白的表达,表明这些小分子具有潜在的柑橘免疫诱导活性,可作为潜在的黄龙病防治药物。
当前,已证实部分小分子诱导物可用于柑橘黄龙病的治疗。例如,在新梢抽发之季喷洒诱导物β-氨基丁酸、2,1,3-苯并噻二唑、2,6-二氯异烟肼、抗坏血酸、2-脱氧-D-葡萄糖后,PR类蛋白的表达量会大幅度提升,黄龙病的典型症状如叶片黄化斑驳在治疗期间也会得到有效缓解,但治疗效果受到柑橘树龄的影响很大,幼年柑橘苗的恢复效果明显优于成熟的柑橘树[48]。染病柑橘树干注射草酸、磷酸二氢钾、苯并噻二唑、β-氨基丁酸、2,6-二氯异烟酸同样也降低了黄龙病菌的浓度,其中苯并噻二唑可显著提升PR-1、PR-2蛋白的表达量,草酸能够显著提升PR-15蛋白的表达达到植物免疫的目的[14]。虽然免疫诱导物具有治疗黄龙病的效果,但其使用受到主体植物的表型、气候、营养、土壤等条件的影响很大[14];除此之外,诱导免疫反应对营养的竞争还会导致植株生长受限,因此,改善营养条件对于诱导物黄龙病治理效果有很大的影响。Li等[19]联合热疗法、肥料施用、堆肥等控制黄龙病的策略,在田间对诱导物的黄龙病治疗效果进行了评估,旨在发现一种实际有效的田间诱导治疗黄龙病的方法。其中,β-氨基丁酸和抗坏血酸在施用氮肥后不仅治疗效果显著,而且柑橘产量有很大的提升,因此,改善土壤、施用肥料的措施可以与诱导物一起形成黄龙病综合治理的有效方法。虽然免疫诱导物在黄龙病的免疫治疗当中起到了一定的作用,但仍然存在不足:(1)常规诱导物的免疫诱导作用弱于天然诱导物水杨酸;(2)单独使用诱导物并不能有效控制黄龙病病情等。因此,围绕免疫诱导物,如何结合其他药物达到共同治疗黄龙病的目的,是免疫诱导物研究今后关注的重点内容。
4 柑橘黄龙病的纳米药物防治策略
纳米技术在农业领域被认为是一项有助于控制作物病虫害增加作物产量的新技术,包括:(1)应用纳米传感器对植物病害进行诊断;(2)纳米制剂减小农药的使用量;(3)使用金属纳米制剂控制植物病害。在黄龙病化学药物治疗领域当中,面临的最大难题是柑橘叶片表面的超疏水蜡质层导致药物传递效率极低,而纳米粒子具有较小的尺寸(1~100 nm)和巨大的比表面积以及可在其表面修饰不同的化合物等特性,可改变药物疏水性质、增加柑橘叶片对药物的吸收。例如, Yang等[34]合成的阿莫西林-Brij-35纳米乳(液滴尺寸5.26 ± 0.04 nm 和94 ± 1.48 nm)不仅增强了抗生素在水中的溶解度,还提高了抗生素进入柑橘叶片的有效浓度,“突破”了蜡质层对药物分子运抵韧皮部的屏障,药物传递效率提升了3.3倍,治疗效果相对于非纳米乳制剂有显著提升。Hu等[49]利用以N-甲基-2-吡咯烷酮和二甲亚砜为溶剂和助溶剂,聚氧乙烯蓖麻油、聚亚烷基二醇和聚氧乙烯十三烷基醚磷酸酯为表面活性剂合成了具有治疗功能的纳米乳剂。结果表明,包括Agrobacterium tumefaciens、Escherichia coli strain DH5α、Liberibacter crescens、Xanthomonas citri subsp.citri、Rhizobium etli、Bradyrhizobium japonicum、Mesorhizobium loti和Sinorhizobium meliloti在内的8种细菌,靶向药物纳米乳剂(图1,6~16)的最小杀菌浓度都几乎相当于链霉素,相对于常规的靶向药物,药效得到了显著提升。
锌制剂在植物病害保护中有重要的作用,而氧化锌一直被视作农业肥料,但其较低的溶解度限制了其在黄龙病防治中的应用,而纳米技术为提高其生物利用度提供了新的思路。纳米级金属制剂具有较高的溶解度和巨大的比表面积,可以催化产生单线态氧,表现出强大的杀菌能力[22]。二维结构的纳米氧化锌在控制柑橘溃疡病方面比铜金属抗菌剂更强的作用,研究表明,喷洒0.56 kg/hm2的纳米氧化锌治疗感染溃疡病的重症柑橘,幼苗的感染率平均下降了40%,而成熟柑橘树的感染率下降15%,同时,在治疗期间并没有观察到显著的生理毒性[50]。330 mg/L(1∶1)二硫白蛋白-纳米氧化锌(4 nm)复合溶液,树干注射感染黄龙病的嫁接柑橘甜橙,在1-3月中抑菌效果高达97%,细菌浓度相对于水控制组减小了21~43倍[21]。除锌纳米粒子外,银纳米粒子也被广泛地应用于抗菌制剂的开发,银胶(50 mg/L)(10~100 nm)和氢氧化铝(200 mg/L)浸泡过的患黄龙病嫁接柑橘树6个月后的综合指数显示,治疗效果是对照处理(水/DMSO)的2.5~5倍,氢氧化铝处理过的柑橘症状基本恢复正常[51]。Zhang等[23]通过3 a的田间试验,对3年生的黄龙病阳性柑橘叶面喷洒200 mg/L硝酸银和福赛特铝(5.60 kg/hm2)进行联合热处理,结果表明,二者对黄龙病治疗效果良好。这些试验都证实,金属纳米药物可有效地清除黄龙病或通过设计完成对黄龙病的治疗。
5 展 望
柑橘黄龙病作为世界上危害柑橘生产的主要病害,目前仍无根除柑橘黄龙病的有效方法,严重制约着柑橘产业的高质量发展。纳米技术的出现为柑橘黄龙病的防治提供了新思路、新方法和新技术。利用纳米技术创制高效、低残留的纳米农药已成为绿色农药领域的研究热点,以防治柑橘黄龙病的有效性与安全性为目标,开展多学科交叉的联合攻关,探究纳米农药与病菌及植物间的互作原理,解析纳米药物的靶向递送机制,推动纳米技术在包括柑橘黄龙防控在内的农业领域中的应用研究。
[1] BOVÉ J M.Huanglongbing:a destructive,newly-emerging,century-old disease of citrus[J].J Plant Pathol,2006,88(1):7-37.
[2] REINKING O A.Diseases of economic plants in southern China[J].Phillip Agric,1919,8(4):109-135.
[3] 林孔湘.柑桔黄梢(黄龙)病研究[J].植物病理学报,1956,2(1):1-42.LIN K H.Etiological studies of yellow shoot of citrus[J].Acta phytopathol sinca,1956,2(1):1-42 (in Chinese).
[4] 柯冲,林先沾,陈辉,等.柑桔黄龙病与类立克次体及线状病毒的研究初报[J].科学通报,1979(10):463-466.KE C,LIN X Z,CHEN H,et al.A preliminary report on the study of citrus Huanglongbing with Rickettsia-like organism and viruses[J].Chinese science bulletin,1979 (10):463-466 (in Chinese).
[5] JAGOUEIX S,BOVÉ J M,GARNIER M.The phloem-limited bacterium of greening disease of citrus is a member of the alpha-subdivision of the proteobacteria[J].Int J Syst Bacteriol,1994,44(3):379-386.
[6] 吕亮,肖翠,仝铸,等.柑桔黄龙病三种媒介昆虫的研究进展[J].中国南方果树,2020,49(2):161-169.LÜ L,XIAO C,QUAN Z,et al.Research progress on three vector insects of citrus Huanglongbing[J].South China fruits,2020,49(2):161-169 (in Chinese).
[7] FOLIMONOVA S Y,ROBERTSON C J,GARNSEY S M,et al.Examination of the responses of different genotypes of citrus to Huanglongbing (citrus greening) under different conditions[J].Phytopathology,2009,99(12):1346-1354.
[8] MANN R S,ALI J G,HERMANN S L,et al.Induced release of a plant-defense volatile ‘deceptively’ attracts insect vectors to plants infected with a bacterial pathogen[J/OL].PLoS Pathog,2012,8 (3):e1002610- e1002623 [2020-11-13].https://doi.org/10.1371/journal.ppat.1002610.
[9] BELASQUE J J,BASSANEZI R B,YAMAMOTO P T,et al.Lessons from huanglongbing management in São Paulo,Brazil[J].J Plant Pathol,2010,92(2):285-302.
[10] TIWARI S,MANN R S,ROGERS M E.Insecticide resistance in field populations of Asian citrus psyllid in Florida[J].Pest Manag Sci,2011,67(10):1258-1268.
[11] COYLE J F,LORCA G L,GONZALEZ C F.Understanding the physiology of liberibacter asiaticus:an overview of the demonstrated molecular mechanisms[J].J Mol Microbiol Biotechnol,2018,28(3):116-127.
[12] MERFA M V,PEREZ L E,NARANIO E,et al.Progress and obstacles in culturing ‘Candidatus Liberibacter asiaticus’,the bacterium associated with Huanglongbing[J].Phytopathology,2019,109(7):1092-1101.
[13] PAEKER J K,WISOTSKY S R,JOHNSON E G,et al.Viability of ‘Candidatus Liberibacter asiaticus’ prolonged by addition of citrus juice to culture medium[J].Phytopathology,2014,104(1):15-26.
[14] HU J H,JIANG J X,WANG N.Control of citrus Huanglongbing (HLB) via trunk injection of plant activators and antibiotics[J].Phytopathology,2018,108(2):186-195.
[15] ZHANG M Q,GUO Y,POWELL C A,et al.Effective antibiotics against ‘Candidatus Liberibacter asiaticus’ in HLB-affected citrus plants identified via the graft-based evaluation[J/OL]. PLoS One,2014,9(11):e111032-e111042 [2020-11-13].http://dx.doi.org/ 10.1371/journal.pone.0111032.
[16] BARNETT M J,SOLOW C D E,LONG S R.A high-throughput system to identify inhibitors of Candidatus Liberibacter asiaticus transcription regulators[J].Proc Natl Acad Sci U S A,2019,116(36):18009-18014.
[17] PAGLIAI F A,COYLE J F,KAPOOR S,et al.LdtR is a master regulator of gene expression in Liberibacter asiaticus[J].Microb Biotechnol,2017,10(4):896-909.
[18] ZUO R,DE O A,BULLITA E,et al.Identification of flavonoids as regulators of YbeY activity in Liberibacter asiaticus[J].Environ Microbiol,2019,21(12):4822-4835.
[19] LI J Y,LI L,PANG Z Q,et al.Developing citrus Huanglongbing (HLB) management strategies based on the severity of symptoms in HLB-endemic citrus-producing regions[J]. Phytopathology,2019,109(4):582-592.
[20] PALMER I A,CHEN H,CHEN J,et al.Novel salicylic acid analogs induce a potent defense response in Arabidopsis[J/OL].Int J Mol Sci,2019,20(13):3356-3370 [2020-11-13].https://doi.org/10.3390/ijms20133356.
[21] GHOSH D K,KOKANE S,KUMAR P,et al.Antimicrobial nano-zinc oxide-2S albumin protein formulation significantly inhibits growth of ‘Candidatus Liberibacter asiaticus’ in planta[J/OL].PLoS One,2018,13(10):e0204702- e0204721 [2020-11-13].http://doi.org/10.1371/journal.pone.0204702.
[22] YOUNG M,OZCAN A,MYERS M E,et al.Multimodal generally recognized as safe ZnO/nanocopper composite:a novel antimicrobial material for the management of citrus phytopathogens[J].J Agric Food Chem,2018,66(26):6604-6608.
[23] ZHANG M Q,YANG C Y,POWELL C A,et al.Field evaluation of integrated management for mitigating citrus Huanglongbing in Florida[J/OL].Front Plant Sci,2019,9:1890-1915 [2020-11-13].https://doi.org/10.3389/fpls.2018.01890.
[24] MCMANUS P S,STOCKWELL V O,SUNDIN G W,et al.Antibiotic use in plant agriculture[J].Annu Rev Phytopathol,2003,40(1):443-465.
[25] STOCKWELL V O,DUFFY B.Use of antibiotics in plant agriculture[J].Rev Sci Tech Off Int Epizoot,2002,31:199-210.
[26] 赵学源,邱柱石,苏维芳,等.四环素浸泡芽条消除柑桔黄龙病的持续效果[J].植物保护学报,1982(1):67-68.ZHAO X Y,QIU Z S,SU W F,et al.Continuous effect of soaking shoots with tetracycline on citrus Huanglongbing[J].Plant protection,1982(1):67-68 (in Chinese).
[27] ZHENG Z,CHEN J C,DENG X L.Historical perspectives,management,and current research of citrus HLB in Guangdong Province of China,where the disease has been endemic for over a hundred years[J].Phytopathology,2008,108(11):1224-1236.
[28] BLAUSTEIN R A,LORCA G L,TEPLITSKI M.Challenges for managing Candidatus Liberibacter spp.(Huanglongbing disease pathogen):current control measures and future directions[J].Phytopathology,2018,108(4):424-435.
[29] 姚廷山,周彦,DIANN A,等.土霉素处理对Valencia夏橙中淀粉及相关基因表达的影响[J].园艺学报,2019,46(2):227-236.YAO T S,ZHOU Y,DIANN A,et al.Effect of oxytetracycline on the expression of starch and related genes in HLB-affected valencia[J].Hortic Plant J,2019,46(2):227-236(in Chinese with English abstract).
[30] HUSSAIN S,RAO M J,ANJUM M A,et al.Effect of different combinations of antibiotics on fruit quality and antioxidant defense system in Huanglongbing infected Kinnow orchards[J/OL].AMB express,2019,9(1):147-154 [2020-11-13]. https://doi.org/10.1186/s13568-019-0871-9.
[31] ZHANG M Q,POWELL C A,GUO Y,et al.Characterization of the microbial community structure in Candidatus Liberibacter asiaticus-infected citrus plants treated with antibiotics in the field[J/OL].BMC Microbiol,2013,13:112-121 [2020-11-13].https://doi.org/10.1186/1471-2180-13-112.
[32] WANG N,HU J H.Evaluation of spatiotemporal dynamics of oxytetracyline and its control effect against citrus Huanglongbing[J].Phytopathology,2016,106(12):1495-1503.
[33] 吕志果.药剂输液滴干对柑橘黄化的影响[D].南宁:广西大学,2018.LÜ Z G.Effect of infusion and drip drying on citrus yellowing [D].Nanning:Guangxi University,2018 (in Chinese with English abstract).
[34] YANG C Y,POWELL C A,DUAN Y P,et al.Antimicrobial nanoemulsion formulation with improved penetration of foliar spray through citrus leaf cuticles to control citrus Huanglongbing[J/OL].PLoS One,2015,10(7):e0133826[2020-11-13].http://dx.doi.org/10.1371/journal.pone.0133826.
[35] DUAN Y P,ZHOU L J,HALL D G,et al.Complete genome sequence of citrus Huanglongbing bacterium ‘Candidatus Liberibacter asiaticus’ obtained through metagenomics[J].Mol Plant Microbe Interact,2009,22(8):1011-1020.
[36] AKULA N,TRIVED P,HAN F Q,et al.Identification of small molecule inhibitors against SecA of Candidatus Liberibacter asiaticus by structure based design[J].Eur J Med Chem,2012,54:919-924.
[37] AKULA N,TRIVED P,HAN F Q,et al.Discovery of novel SecA inhibitors of Candidatus Liberibacter asiaticus by structure based design[J].Bioorg Med Chem Lett,2011,21(14):4183-4188.
[38] GARDNER C,PAGLIAI F A,PAN L.Drug repurposing:tolfenamic acid inactivates PrbP,a transcriptional accessory protein in Liberibacter asiaticus[J/OL].Front Microbiol,2016,7:1630-1645[2020-11-13].https://doi.org/10.3389/fmicb.2016.01630.
[39] PAGLIAI F A,GARDNER C L,BOJILOVA L,et al.The transcriptional activator LdtR from ‘Candidatus Liberibacter asiaticus’ mediates osmotic stress tolerance[J/OL].PLoS pathogens,2014,10(4):e1004101[2020-11-13].http://doi.org/10.1371/journal.ppat.1004101.
[40] MOU Z L,FAN W H,DONG X N.Inducers of plant systemic acquired resistance regulate npr1 function through redox changes[J].Cell,2003,113(7):935-944.
[41] FU Z Q,DONG X N.Systemic acquired resistance:turning local infection into global defense[J].Annu Rev Plant Biol,2013,64:839-863.
[42] KATOH H,MIYATA S I,INOUE H,et al.Unique features of a Japanese ‘Candidatus Liberibacter asiaticus’ strain revealed by whole genome sequencing[J/OL].PLoS One,2014,9:e106109[2020-11-13].https://doi.org/10.1371/journal.pone.0106109.
[43] LIN H,HAN C S,LIU B H,et al.Complete genome sequence of a Chinese strain of ‘Candidatus Liberibacter asiaticus’[J].Genome announcements,2013,1(2):e00184-13[2020-11-13].https://doi.org/10.1128/genomeA.00184-13.
[44] LI J Y,PANG Z Q,TRIVEDI P,et al.‘Candidatus Liberibacter asiaticus’ encodes a functional salicylic acid (SA) hydroxylase that degrades SA to suppress plant defenses[J].Mol Plant Microbe Interact,2017,30(8):620-630.
[45] DEKKERS M G H,GRAHAMJ H,BURNS J K,et al.Evaluation of chemical inducers and PR protein reporters for induced systemic resistance to citrus bacterial diseases[J].Phytopathology,2004,94(6):S25.
[46] FRANCIS M I,REDONDO A,BURNS J K,et al.Soil application of imidacloprid and related SAR-inducing compounds produces effective and persistent control of citrus canker[J].Eur J Plant Pathol,2009,124(2):283-292.
[47] GRAHAM J H,MYERS M E.Integration of soil applied neonicotinoid insecticides and acibenzolar-S-methyl for systemic acquired resistance (SAR) control of citrus canker on young citrus trees[J].Crop Prot,2013,54:239-243.
[48] LI J,YTRIVED P,WANG N.Field evaluation of plant defense inducers for the control of citrus Huanglongbing[J].Phytopathology,2016,106(1):37-46.
[49] HU J H,AKULA N,WANG N.Development of a microemulsion formulation for antimicrobial SecA inhibitors[J/OL].PLoS One,2017,11(3):e0150433[2020-11-13].http://dx.doi.org/10.1371/journ al.pone.0150433.
[50] GRAHAM J H,JOHNSON E G,MYERS M E,et al.Potential of nano-formulated zinc oxide for control of citrus canker on grapefruit trees[J].Plant Dis,2016,100(12):2442-2447.
[51] YANG C Y,ZHONG Y,POWELL C A,et al.Antimicrobial compounds effective against Candidatus Liberibacter asiaticus discovered via graft-based assay in citrus[J].Sci Rep,2018,8(11):1-11.