聚-γ-谷氨酸(poly-γ-glutamic acid,PGA)是绿色安全的肥料增效剂[1],被广泛地应用于农业、化妆品、食品、医药等多个领域[2-3]。PGA在柑橘中应用可改善果实品质[4]。PGA降解产物为L-谷氨酸[1],谷氨酸脱羧酶(GAD)可将L-谷氨酸转化为γ-氨基丁酸(GABA)。GABA在植物中有多种生物功能,如:调节细胞环境pH、调节碳氮营养平衡、应答环境胁迫、调控生长发育等[5-6]。有研究证明补充外源GABA,可增加柑橘类植物内源GABA、几种氨基酸和植物激素的水平[7]。超氧化物歧化酶(SOD)、过氧化物酶(POD)和多酚氧化酶(PPO)3种酶活性与植物抗性相关,可作为筛选抗性材料的生化指标之一[8]。目前,PGA在柑橘产业中的应用不多,对PGA在柑橘苗木繁育上的应用效果以及PGA的作用机制仍然不清楚。本研究探讨聚-γ-谷氨酸(PGA)水溶液灌根对柑橘个体性状及抗性相关酶的影响,并采用亲水相互作用色谱(HILIC LC-MS/MS)分析PGA灌根前后叶片中200个靶向代谢物含量的变化,对永春芦柑嫁接苗叶片进行靶向代谢物分析,以期为聚-γ-谷氨酸在柑橘良种繁育上的应用提供更明确的理论依据,也为深入地探索PGA的作用机制、更好地发挥PGA的作用奠定理论基础。
1 材料与方法
1.1 柑橘实生苗PGA处理及酶活性的测定
试验在华中农业大学国家果树脱毒种质资源室内保存中心进行。柑橘品种为强德勒柚(Citrus maxima),柑橘幼苗生长至35 d时,分别用质量浓度50、100、200 mg/L的聚-γ-谷氨酸溶液浇灌,CK组用清水浇灌。聚-γ-谷氨酸由华中农业大学农业微生物学国家重点实验室提供。
在处理后的2、4、6 d分别测定柚苗叶片中3种酶的活性。SOD采用氮蓝四唑(NBT)法、POD采用愈创木酚法、PPO采用邻苯二酚法,根据文献[9-10]的方法进行测定。
1.2 PGA促进采穗树和嫁接苗生长的试验
试验在福建省永春绿源柑橘苗木繁育场进行。
处理方法:每次以质量浓度200 mg/L的PGA溶液灌根,平均每株280 mL,对照为清水处理。
第1批试验在3号育苗网室中进行。根据永春芦柑(Citrus reticulata Banco.)苗木的原始株高分组。A组:70~79 cm;B组:80~89 cm;C组:90 cm以上。试验时间:2016年3月6日第1次处理,4月6日第2次处理,5月6日观察记载株高和冠径。
第2批试验在1号育苗网室中进行。试验时间为2016年4月6日第1次处理,5月6日第2次处理,6月27日观察记载株高和分枝数。50株永春芦柑嫁接苗用PGA处理,50株用于对照试验。
试验数据使用IBM SPSS Statistics进行平均值的t-检验统计学分析,以判断差异的显著水平。
1.3 靶向代谢物的HILIC LC-MS/MS定量分析
1)样品的制备。用200 mg/L PGA浇灌永春芦柑嫁接苗,每次1 L/株,隔30 d处理1次,第3次处理后的24 h取嫁接苗叶片,用液氮冷冻,贮存于-70 ℃超低温冰箱,每个处理设6个生物学重复。样本加入液氮研磨后称量80 mg,分别加入1 mL甲醇乙腈水溶液(V甲醇 ∶V 乙腈∶V水=2∶2∶1),涡旋60 s;低温超声30 min,2次;-20 ℃放置1 h沉淀蛋白,过滤管过滤后于4 ℃、12 000 r/min离心20 min,取上清冷冻干燥。
2)色谱质谱条件。样品采用Waters I-class超高效液相色谱仪(Waters)进行分离。使用AB 5500 QqQ质谱仪(AB SCIEX)进行质谱分析。色谱条件:流动相A为水溶液+25 mmol/L乙酸铵+25 mmol/L氨水(pH 9.75),流动相B为乙腈。样品置于4 ℃自动进样器中,柱温40 ℃,流速为0.3 mL/min,进样量2 μL。液相梯度如下:0~1 min,B维持在95%;1~14 min,B从95%线性变化到65%;14~16 min,B从65%线性变化到40%;16~18 min,B维持在40%;18~18.1 min,B从40%线性变化到95%;18.1~23 min,B维持在95%。样本队列中每隔6个实验样本设置1个QC样本,用于检测和评价系统的稳定性及重复性。质谱条件:采用AB 5500 QqQ质谱仪(AB SCIEX)进行质谱分析。ESI源条件如下:载气温度,350 ℃;干气温度,350 ℃;载气流量,11 L/min;干气流量,10 L/min;毛细管电压,4 000 V或-3 500 V,分别为正负模式;喷嘴电压,500 V;雾化器压力,0.2 MPa。采用MRM模式监测,每个MRM离子对的停留时间(dwell time)为3 ms,总的循环时间为1.263 s。
3)数据处理。采用MRM Analyzer(R)对200个代谢物的MRM原始数据进行提取,得到各代谢物的峰面积,数据集以及数据分析过程参考Cai等[11]建立的高通量靶向代谢组方法,对生物样本进行代谢谱分析,以HILIC超高效液相色谱-QqQ MS MRM技术为分析平台,对32个KEGG通路中的近200个代谢物进行靶向定量分析,随后采用MRMAnalyzer软件对数据进行处理。
2 结果与分析
2.1 聚-γ-谷氨酸对柑橘叶片中3种抗性相关酶的影响
50和100 mg/L PGA浇灌柚苗2 d后,SOD活性均显著高于CK;200 mg/L的PGA浇灌柚苗2 d后,SOD活性均显著高于100 mg/L的PGA处理。3种质量浓度的PGA浇灌柚苗4 d后,SOD活性均显著高于CK,200 mg/L PGA处理与100和50 mg/L的PGA处理之间也存在着显著差异。处理后6 d,100 mg/L PGA处理柚苗叶SOD活性显著高于CK和50 mg/L PGA处理(图1A)。图2为柚实生苗生长情况。
3种质量浓度PGA处理2 d后,POD活性与CK均有显著差异,100 mg/L PGA浇灌柚苗2 d后,POD活性均显著高于50 mg/L PGA处理。3种质量浓度的PGA浇灌柚苗4 d和6 d后POD活性均显著高于CK(图1B)。
50、100 mg/L的PGA处理2 d后,PPO活性显著高于CK,200 mg/L处理的柚苗PPO活性显著高于50 mg/L的PGA处理。50 mg/L的PGA处理后4 d,柚苗PPO活性显著高于CK,100和200 mg/L PGA处理后PPO活性均显著高于50 mg/L PGA处理(图1C)。
2.2 聚-γ-谷氨酸对采穗树生长和分枝数的影响
图3为采穗树处理和对照实物照片,处理树叶色浓绿、枝梢生长健壮、树冠丰满,对照树长势相对较弱。在永春芦柑采穗树生长试验中,对采穗树3组数据进行统计分析,结果表明:A组处理后与处理前比较,株高显著提高(P<0.05),B组处理后与处理前比较,株高和冠径显著提高(P<0.05),但C组处理后与处理前比较差异不显著(见图4A、B)。

不同小写字母表示在α=0.05水平差异显著。下同。 Different lowercase letters in the data of the same column indicate the significance of the difference at α=0.05. The same as below.
图1 PGA处理对柚苗叶片中超氧化物歧化酶(A)、过氧化物酶(B)和多酚氧化酶(C)活性的影响
Fig.1 Effects of PGA treatment on pomelo seedlings leaves’ activities of superoxide dismutase(A),
peroxidase(B) and polyphenol oxidase(C)

左为对照,右为200 mg/L PGA 处理。Left:CK;Right:200 mg/L PGA treatment.
图2 PGA处理和对照的柚实生苗
Fig.2 Photo of pomelo seedlings after 200 mg/L
PGA treatment and control

图3 永春芦柑采穗树(A)和对照树(B)表型
Fig.3 Phenotype of Yongchun tangerine scion
trees(A) and control trees(B)
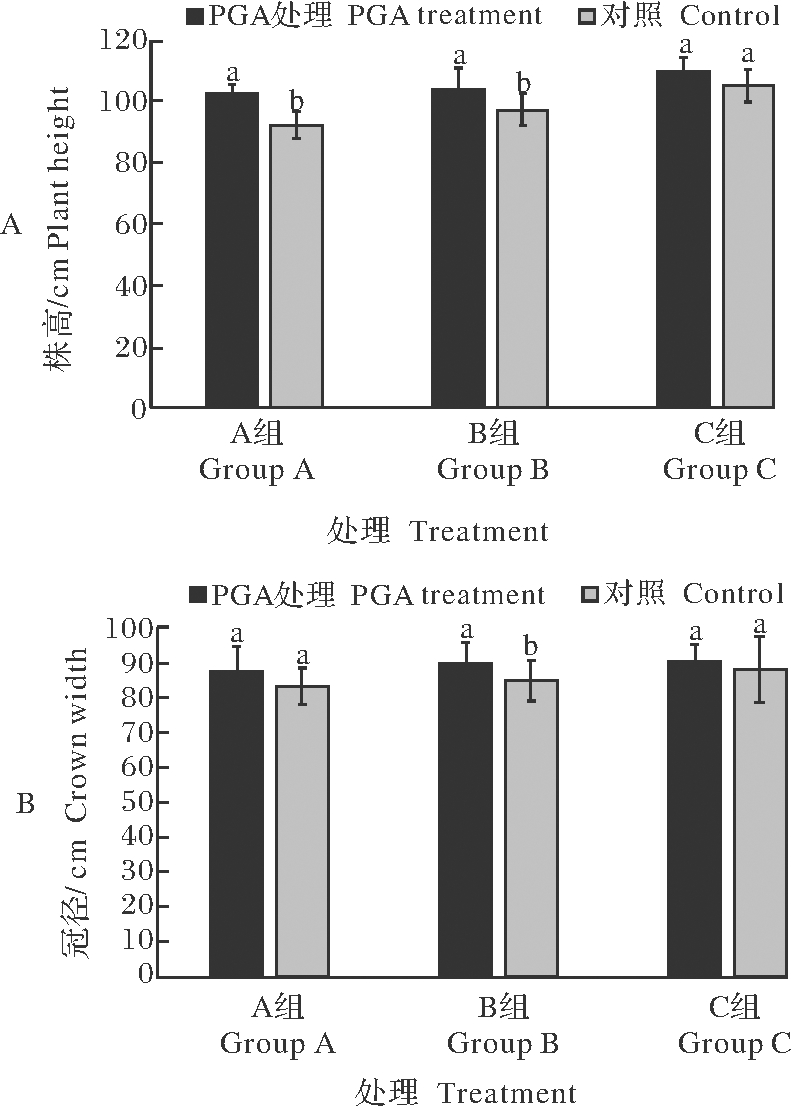
A组:株高70~79 cm; B组:株高80~89 cm; C组:株高>90 cm。Group A:Plant height 70~79 cm; Group B:Plant height 80~89 cm; Group C:Plant height>90 cm.
图4 永春芦柑采穗树经PGA处理后
的株高(A)和冠径(B)的变化
Fig.4 Changes in plant height(A) and crown diameter (B)
of Yongchun tangerine tree after PGA treatment
在永春芦柑无病毒嫁接苗生长试验中,200 mg/L的PGA处理的苗木与对照相比,平均株高增加12.3%,处理和对照的株高存在显著差异。分枝数从平均3.5枝/株增加到平均4.8枝/株,分枝数显著增加38.6%(P<0.05)(图5)。根据常规苗木繁育方法,每枝接穗平均提供10个饱满芽,200株苗可以增加约2 600个芽。可见,PGA处理显著增加了苗木芽数,可以提供丰富的育苗材料。
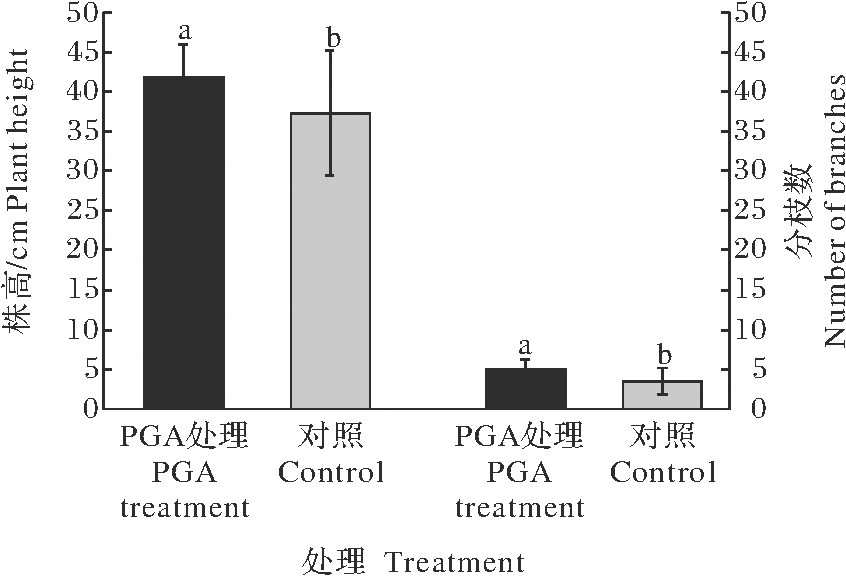
图5 永春芦柑嫁接苗经PGA处理后
的株高和分枝数的变化
Fig.5 Changes in plant height and number of branches
in Yongchun tangerine tree after PGA treatment
2.3 PGA处理后叶片中200个靶向代谢物的定量分析
采用HILIC LC-MS/MS靶向代谢组学方法,对样本中的200种代谢物进行MRM分析,共检测到109个代谢物,这些代谢物在QC样本中的RSD<30%,说明实验系统稳定可靠。对PGA处理和对照的显著性差异代谢物(假设概率<0.05且变异位数>1.5)进行层次聚类(hierarchical clustering),PGA处理的样品聚类出现在同一簇,对照的6个重复样本聚类出现在同一簇。同时,聚在同一簇内的代谢物具有相似的表达模式(图6)。
在进行PGA处理和对照2组样本间的差异代谢物分析时,利用单变量分析,可以直观地显示PGA处理样品与对照样品之间代谢物变化的差异显著性。本研究以假设概率<0.05且变异位数>1.5作为显著性差异物的筛选标准进行差异代谢物表达量分析(表1,图5)。PGA处理与对照相比,有13种代谢物表现出显著的差异,其中N6-甲基腺嘌呤(N6-methyladenosine,m6A)、γ-氨基丁酸(gamma-aminobutyric acid,GABA)、腺嘌呤(adenine)、吡哆醇(pyridoxine)、2′-O-甲基腺苷(2′-O-methyladenosine)、苹果酸(malic acid)、L-甲硫氨酸(L-methionine)和L-2-hydroxygluterate 等8种代谢物上调;5′-环磷酸腺苷(adenosine 3′,5′-cyclic monophosphate,cAMP)、L-谷氨酸(L-glutamic acid)、甘氨酸(glycine)、L-二氢乳清酸(L-dihydroorotic acid)和甘油-3-磷酸(sn-glycerol 3-phosphate)等5种代谢物下调(表1)。

红色代表上调,蓝色代表下调;颜色深浅与 Fold change值大小相关。Red shows up-regulated,blue shows down-regulated;color depth is related to the size of the Fold change value.
图6 PGA处理组和对照组的差异代谢物的层次聚类结果
Fig.6 Hierarchical clustering results of different metabolites between PGA treatment group and control group
表1 PGA处理后差异显著的代谢物信息
Table 1 Metabolite information with significant difference after PGA treatment

编号No. 代谢物名称Metabolite nameKEGG路径KEGG保留时间/minRetention time相对标准误差RSD变异位数Fold change假设概率P-value1N6-甲基腺嘌呤N6-Methyladenosine-3.6850.0812.268 ↑0.00123',5'环状单磷酸腺苷Adenosine3',5'-cyclic monophosphate (cAMP)C005757.8940.1180.653 ↓0.0013谷氨酸L-Glutamic acidC0002511.9550.0870.732 ↓0.0024γ-氨基丁酸Gamma-aminobutyric acid (GABA)C0033411.1460.1181.645 ↑0.0045甘氨酸 GlycineC0003710.8410.2000.681 ↓0.0066腺嘌呤AdenineC001474.7100.2031.546 ↑0.0097L-二氢乳清酸L-Dihydroorotic acidC003378.6000.1220.616 ↓0.0128吡哆醇PyridoxineC003142.7030.1131.747 ↑0.01492'-O-甲基腺苷2'-O-MethyladenosineC047792.6210.1941.871 ↑0.03010苹果酸Malic acidC0071112.2510.1011.263 ↑0.03411甘油-3 -磷酸sn-Glycerol 3-phosphateC0009313.2560.1970.373 ↓0.03612L-甲硫氨酸L-MethioninegluterateC000738.2660.1551.654 ↑0.03813L-2-羟基戊二酸L-2-HydroxygluterateC0319612.0200.1851.706 ↑0.039
注:↑表示上调,↓表示下调。Note:↑ shows up-regulated,↓ shows down-regulated.
3 讨 论
3.1 PGA与柑橘苗木生长及抗逆境能力关系
本研究结果表明PGA能提高永春芦柑采穗树和嫁接苗的株高、冠径和分枝数,丰富柑橘育苗材料。在实生苗上的研究表明PGA处理能提高植株SOD、POD、PPO3种酶的活性,这与前人[12-13]关于多种因素可以激发抗性相关酶的观点是一致的。超氧化物歧化酶是生物体内存在的一种抗氧化金属酶,它能够催化超氧阴离子自由基歧化生成氧和过氧化氢,在机体氧化与抗氧化平衡中起到至关重要的作用。超氧化物歧化酶和过氧化物酶是细胞内清除活性氧系统中的重要酶,能有效地阻止![]() 和H2O2在植物体内积累[14]。多酚氧化酶是植物体内普遍存在的一种末端氧化酶,其氧化产物醌类物质对病原物具有比酚类物质更强的毒性,对植物抗病起着重要的作用[15]。
和H2O2在植物体内积累[14]。多酚氧化酶是植物体内普遍存在的一种末端氧化酶,其氧化产物醌类物质对病原物具有比酚类物质更强的毒性,对植物抗病起着重要的作用[15]。
3.2 GABA和m6A参与PGA对植物生长及抗性调节过程
m6A是真核生物mRNA上含量最多的化学修饰之一,m6A修饰是动态可逆的,可在时间和空间上被甲基转移酶和去甲基酶调控。除了RNA存在m6A修饰之外,DNA的m6A也在包括秀丽隐杆线虫和果蝇在内的多细胞真核生物中被鉴定出来,并进一步在植物、小鼠和人类细胞等高等真核生物中得到鉴定。m6A在调控DNA复制、转座、转录和细胞防御中起着关键作用。代谢组研究结果显示,PGA处理植株与对照植株相比m6A提高了2.3倍,表明PGA与m6A的变化水平具有相关性,暗示m6A可能参与PGA对植物促生长的作用过程。
前人研究中GABA用于促进植物的生长[16],抑制某些植物病害[17];GABA参与调节细胞内pH环境、碳氮营养平衡、抑制昆虫啃食、防止氧化胁迫、渗透调节、信号传递等在内的多种生理生化反应[18-22]。本研究中对柑橘嫁接苗进行PGA灌根处理,与对照植株相比L-谷氨酸下调73.2%,而GABA上调了1.6倍。在GABA含量小幅度提高的情况下,柑橘苗木各项生长指标得以提高,抗氧化能力增强且未观察到植株异常的现象。PGA处理能激发GABA含量提高,这一结果在前人的研究中还未见报道,这也为我们进一步探索PGA对植物的调节机制提供了新的方向。
[1] 陈雄,陈守文,喻子牛. 聚-γ-谷氨酸在环境中降解特性的初步研究[J]. 环境科学与技术,2008,30(11):35-37. CHEN X,CHEN S W,YU Z N.Degradability of poly-γ-glutamic acid in environment[J]. Environmental science & technology,2008,30(11):35-37(in Chinese with English abstract).
[2] 李晶博,李丁,邓毛程,等. γ-聚谷氨酸的特性、生产及应用[J]. 化工进展,2008,27(11):1789-1793. LI J B,LI D,DENG M C,et al. Properties,production and application of γ- polyglutamic acid[J]. Chemical industry and engineering,2008,27(11):1789-1793(in Chinese with English abstract).
[3] 王虹. γ-聚谷氨酸及其在水处理中的应用[J]. 化工时刊,2009,23(2):59-61. WANG H.Applications of γ-PGA in water treatment[J]. Chemical industry times,2009,23(2):59-61 (in Chinese with English abstract).
[4] 黄素婵,谢金长,严翔,等. 聚-γ-谷氨酸改善赣南纽荷尔脐橙品质的研究[J]. 中国果菜,2017,37(5):22-27. HUANG S S,XIE J C,YAN X,et al. Study of poly-γ-glutamic acid on the quality of Newhall Navel Orange in the south of Jiangxi Province[J]. China fruit & vegetable,2017,37(5):22-27 (in Chinese with English abstract).
[5] FAIT A,FROMM H,WALTER D,et al. Highway or byway:the metabolic role of the GABA shunt in plants[J].Trends Plant Sci,2007,13 (1):1360-1385.
[6] 宋红苗,陶跃之,王慧中,等. GABA在植物体内的合成代谢及生物学功能[J]. 浙江农业科学,2010(2):225-229. SONG H M,TAO Y Z,WANG H Z,et al. Synthesis metabolism of GABA in plants and its biological functions[J]. Journal of Zhejiang agricultural sciences,2010 (2):225-229 (in Chinese).
[7] HIJAZ F,NEHELA Y,KILLINY N. Application of gamma aminobutyric acid increased the level of phytohormones in Citrus sinensis[J]. Planta,2018,248(4):909-918.
[8] 袁庆华,桂枝,张文淑.苜蓿抗感褐斑病品种内超氧化物歧化酶、过氧化物酶和多酚氧化酶活性的比较[J].草业学报,2002,11(2):100-104. YUAN Q H,GUI Z,ZHANG W S. Comparison of the activities of SOD,POD and PPO within alfalfa cultivars resistant and susceptible to alfalfa common leaf[J].Acta prataculturae sinica,2002,11(2):100-104 (in Chinese with English abstract).
[9] 王学奎.植物生理生化实验原理和技术[M]. 2版.北京:高等教育出版社,2006. WANG X K.Principles and techniques of plant physiological and biochemical experiments[M].2nd ed.Beijing:Higher Education Press,2006 (in Chinese).
[10] 刘风权,王金生. 水杨酸对水稻叶片抗氧化酶系的影响[J]. 农业生物技术学报,2001,9(4):396-399. LIU F Q,WANG J S,Influence of salicylic acid on antioxidant enzymes in rice leaves[J].Journal of agricultural biotechnology,2001,9(4):396-399 (in Chinese with English abstract).
[11] CAI Y,WENG K,GUO Y,et al. An integrated targeted metabolomic platform for high-throughput metabolite profiling and automated data processing[J]. Metabolomics,2015,11 (6):1575-1586.
[12] 刘琴,吴毅歆,薛圆,等. 一种生物诱抗剂防治黄瓜白粉病效果及对诱导酶的影响[J]. 中国农学通报,2013,29(36):367-371. LIU Q,WU Y X,XUE Y,et al. Effect of a biological resistance inducer on controlling cucumber powdery mildew and inducing enzymes activities[J]. Chinese agricultural science bulletin,2013,29 (36):367-371 (in Chinese with English abstract).
[13] 闻静,赵刚,李凤兰,等.大豆矮化突变体IOD、POD、CAT、SOD酶活性的研究[J].作物杂志,2012(3):53-57. WEN J,ZHAO G,LI F L,et al. Studies on the enzyme activities of IOD,POD,SOD,CAT in soybean dwarf mutant[J]. Crops,2012(3):53-57 (in Chinese with English abstract).
[14] 冯坤,郑青松,俞佳虹,等.超氧化物歧化酶的遗传特征及其在植物抗逆性中的研究进展[J].分子植物育种,2017,15 (11):4498-4505.FENG K,ZHENG Q S,YU J H,et al. The characteristics of superoxide dismutase(SOD) in evolutions and its research in plant resistance[J]. Molecular plant breeding,2017,15 (11):4498-4505 (in Chinese with English abstract).
[15] WU Z,HUAN Y,LI Y,et al. Induction of the defense mechanism and antimicrobial compounds produced by Bacillus subtilis sl-44 on pepper (Capsicum annuum L.)[J/OL]. Front microbiol,2019,10:2676[2020-03-18 ].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6892779/.DOI:10.3389/fmicb.2019.02676.
[16] RAMESH S A,TYERMAN S D,XU B,et al. GABA signalling modulates plant growth by directly regulating the activity of plant-specific anion transporters [J/OL].Nat Commun,2015,6:8879[2020-03-18 ]. https://doi.org/10.1038/ncomms8879.
[17] AKAMA K,TAKAIWA F.C-terminal extension of rice glutamate decarboxylase (OsGAD2) functions as an autoinhibitory domain and overexpression of a truncated mutant results in the accumulation of extremely high levels of GABA in plant cells [J]. J Exp Bot,2007,58(10):2699-2707.
[18] GUT H,DOMINICI P,PILATI S,et al. A common structural basis for pH- and calmodulin-mediated regulation in plant decarboxylase [J]. J Mol Boil,2009,392:334-351.
[19] SEIFIKALHOR M,ALINIAEIFARD S,HASSANIB,et al. Diverse role of γ-aminobutyric acid in dynamic plant cell responses[J/OL]. Plant cell reports,2019,30739138[2020-03-18].https://doi.org/10.1007/s00299-019-02396-z.
[20] SHELP B J,BOWN A W,MCLEAN M D. Metabolism and functions of gamma-aminobutyric acid[J]. Trends Plant Sci,1999,4(11):446-452.
[21] BOUCHE’N,FROMM H. GABA in plants:just a metabolite? [J] Trends Plant Sci,2004,9:110-115.
[22] SCOTT-TAGGART C P,VAN CAUWENBERGHE O R,MCLEAN M D,et al. Regulation of γ- aminobutyric acid synthesis in situ by glutamate availability[J]. Physiol Plant,1999,106(4):363-369.