高致病性猪繁殖与呼吸综合征(highly pathogenic porcine reproductive and respiratory syndrome,HP-PRRS)是一种以母猪的繁殖障碍和仔猪的呼吸道疾病为典型特征的传染病[1],其病原是高致病性猪繁殖与呼吸综合征病毒(highly pathogenic porcine reproductive and respiratory syndrome virus,HP-PRRSV)。HP-PRRSV感染后首先在肺和上呼吸道的巨噬细胞[2]和树突状细胞中复制[3],6~12 h后引发病毒血症,病程可持续1~3周[4]。在感染前期(0~7 d),病毒对机体天然免疫的抑制效应大于激活效应[5],主要表现为白细胞数[6]、淋巴细胞百分比[7]和单核细胞数[8]等血常规指标下降。病毒感染使巨噬细胞、胸腺T淋巴细胞凋亡和胸腺萎缩,导致T淋巴细胞数量下降[9]。单核细胞在病毒感染后,从外周血迁移至不同组织分化成巨噬细胞[10],配合组织完成巨噬细胞的定居,共同介导炎症反应和修复受损组织[11],表现为单核细胞数量下降[8]。此外,粒细胞作为急性炎症的标志,机体受创后被募集到损伤部位[12];病毒感染后, IL-1、TNF-α等炎症因子促进骨髓中的干细胞增殖分化为粒细胞,使得血液中的粒细胞数量增多[13]。在感染后期(7~21 d),机体通过激发免疫应答来实现对病毒的清除,各血液指标均逐渐恢复至正常[9]。因此,分析感染期血液指标的变化,对于预测病毒感染后机体状况具有重要意义。
笔者所在课题组前期利用对HP-PRRSV抗病力强的通城猪与易感的大白猪为对象进行人工感染,发现感染后通城猪的白细胞计数和淋巴细胞百分比均显著高于大白猪[14]。本研究以大白猪×通城猪高代横交群体为对象,通过PRRSV人工感染,研究感染后4种血液指标(白细胞计数、淋巴细胞百分比、单核细胞计数、粒细胞百分比)的变化规律以及这些血液指标与血液中病毒载量之间的相关性及与抗病性的关系,旨在为探讨血液指标是否可作为抗病性的指示性状提供科学依据。
1 材料与方法
1.1 血液采集
对72头试验猪(同高国丽等[15]文中一致)在感染前和感染后第4、7、11、14、21、28、35天进行前腔静脉采血(约1 mL抗凝血),立即检测或4 ℃保存待检。
1.2 血常规检测
使用南京迈瑞公司BC-2800Vet兽用全自动血液细胞分析仪检测白细胞计数(WBC)、淋巴细胞百分比(LYMR)、单核细胞计数(MON)、粒细胞百分比(GRAR),后将检测结果录入Excel表中进行统计分析。
1.3 血液指标的差异显著性分析
对感染前和感染后第4、7、11、14、21、28、35天4种血液指标进行测定和计算(平均数±标准差),分析血液指标在感染前后的变化规律;对各时间点血液指标的统计分析采用配对t检验进行差异显著性检验。
根据感染第14天存活与否将试验猪分为抗病和易感2组,14 d存活的为抗病个体,作为抗病组,共有36头;感染后14 d内死亡的为易感个体,作为易感组,共有36头[15]。对抗病和易感2组感染前后同一时间点的血液指标统计分析采用非配对t检验进行差异显著性检验。
使用 GraphPadPrism6.0软件进行数据处理和分析,以 P<0.05表示差异显著、P<0.01表示差异极显著。
1.4 血液指标与病毒载量的相关分析
血清病毒载量结果另文发表[15],本研究对每头猪不同感染时间点检测的病毒载量和血液指标进行相关分析,使用R软件计算Pearson相关系数,并进行显著性检验,P<0.05代表显著相关。
2 结果与分析
2.1 4种血液指标在HP-PRRSV感染后的变化
通过比较感染前后4种血液指标的测定结果(表1),发现白细胞计数在感染第4天极显著降低(P<0.01),第 4~11天逐渐升高,第11~35天波动升高至感染前的水平;淋巴细胞百分比在感染第4天极显著降低(P<0.01),第4~14天逐渐升高,但均显著低于感染前水平;单核细胞计数在感染第4天极显著降低(P<0.01),第4~11天逐渐升高;粒细胞百分比在感染第4天极显著升高至最大值(P<0.01),4~14 d逐渐降低且均显著高于感染前。以上结果显示:试验猪在PRRSV感染前期(0~4 d),各血液指标均产生波动,白细胞、淋巴细胞、单核细胞、粒细胞均在感染第4天达极值;在感染后期(4~35 d)宿主产生一系列的免疫应答来实现对病毒的清除,从而使机体逐渐恢复正常。
表1 4种血液指标不同感染期的情况
Table 1 The 4 hematological parameters from different time points

血液指标Hematological parameters感染时间/d Days post infection0471114212835白细胞数/(×109/L)WBC count26.93±6.6717.60±6.40**19.97±6.19**25.51±7.8526.22±6.5129.13±6.8530.24±7.1831.75±13.98淋巴细胞百分比/%Lymphocyte percentage45.81±7.0933.38±10.78**38.90±10.45**36.37±9.78**42.97±10.00*43.60±10.9048.23±11.5750.10±10.22单核细胞数/(×109/L)Monocyte count1.77±0.590.90±0.47**1.27±0.52**1.64±0.761.70±0.601.85±0.631.73±0.481.87±0.99粒细胞百分比/%Granulocyte percentage47.57±7.0661.54±11.18**54.74±10.45**57.28±10.17**50.52±9.82*50.04±11.2546.08±11.8744.48±10.11
注Note:*:P<0.05;**:P<0.01.
2.2 血液指标在抗病和易感个体之间的差异
通过比较易感和抗病2组同一时间点4种血液指标的测定结果,发现抗病组的白细胞计数、单核细胞计数均从感染第7天开始高于易感组(图1A,图1C);淋巴细胞百分比在感染第7天显著高于易感组(P<0.05)(图1B);粒细胞百分比在感染第7天显著低于易感组(P<0.05)(图1D)。表明抗病与易感组在感染PRRSV后,机体对病毒的应答程度不同,且从感染第7天开始,抗病组能激发更有利的免疫应答来应对病毒感染。
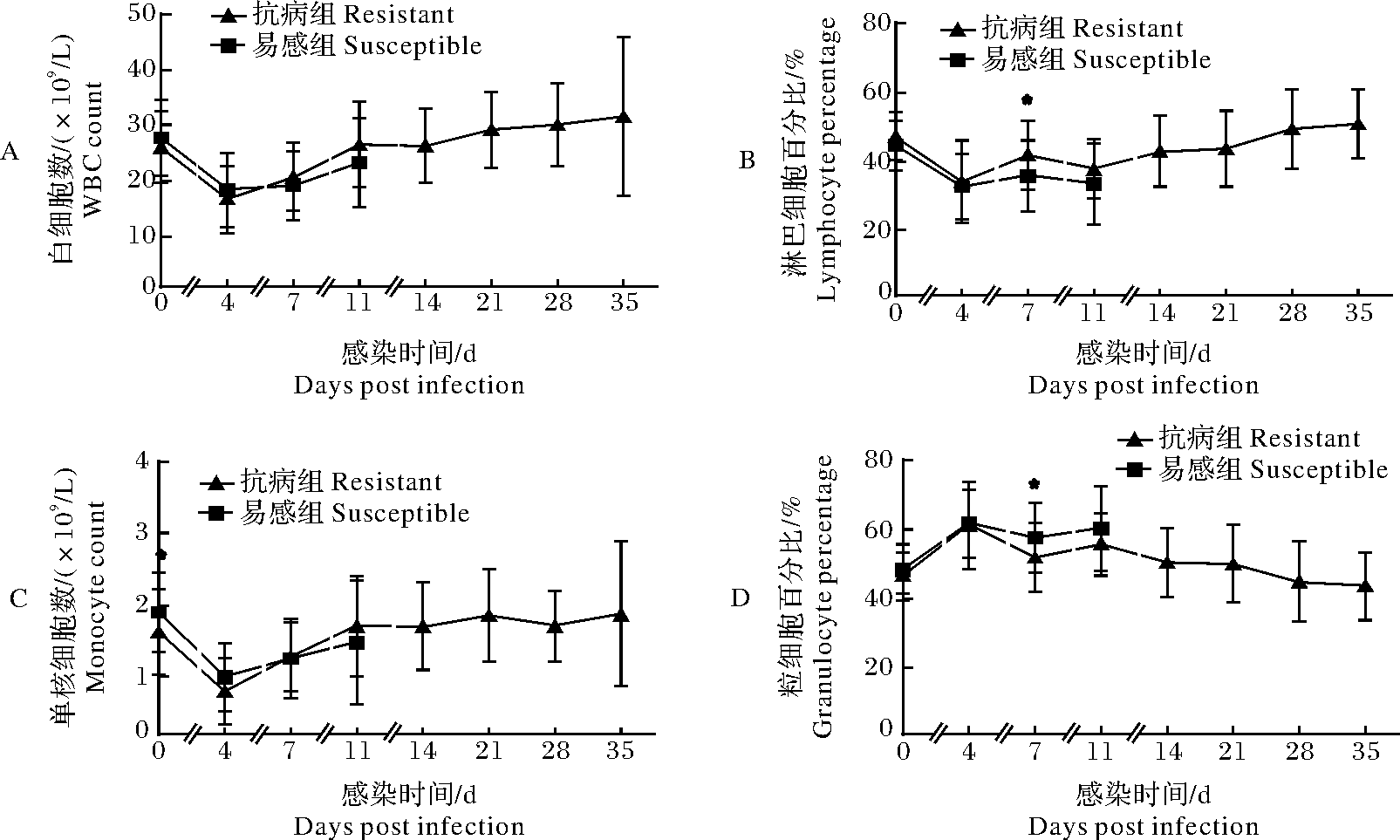
*:P<0.05;**:P<0.01.A:白细胞计数 WBC count;B:淋巴细胞百分比 Lymphocyte percentage;C:单核细胞计数 Monocyte count;D:粒细胞百分比 Granulocyte percentage.
图1 易感和抗病组的4种血液指标变化情况
Fig.1 The 4 hematological parameters of resistant and susceptible
2.3 血液指标与病毒载量的相关性分析
通过对72个个体在感染期的4种血液指标与病毒载量进行相关分析,结果显示(图2),白细胞计数与病毒载量呈极显著负相关(r=-0.31,P<0. 001),淋巴细胞百分比与病毒载量呈极显著负相关(r=-0.36,P<0.001),单核细胞计数与病毒载量呈极显著负相关(r=-0.3,P<0.001),粒细胞百分比与病毒载量呈极显著正相关(r=0.37,P<0. 001)。相关分析结果显示4种血液指标与病毒载量之间均存在中度相关,表明PRRSV感染后不同血液指标的免疫应答及对病毒清除的影响不同。
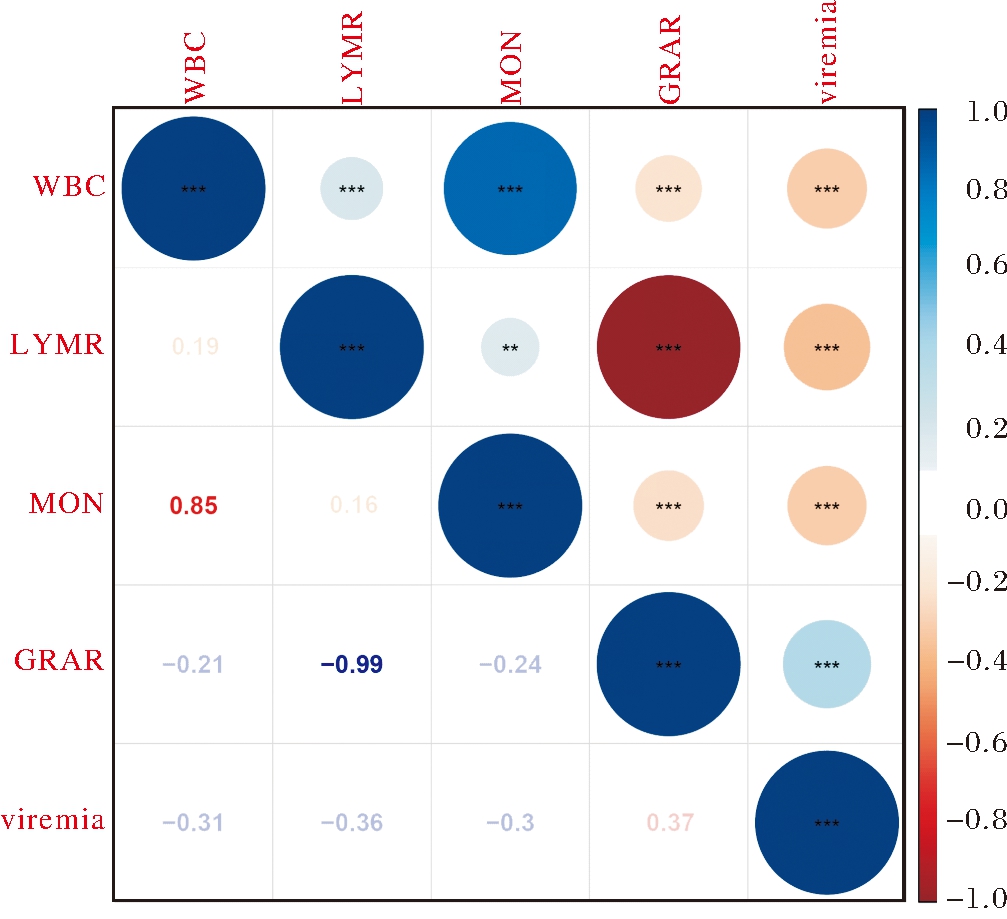
**:P<0.01;***:P<0.001.
图2 4种血液指标与病毒载量的相关分析
Fig.2 The correlations of 4 hematological parameters with viremia
3 讨 论
3.1 HP-PRRSV感染前后4种血液指标的变化
血常规检测可用于机体的状况分析和诊断。PRRSV感染后的不同时期,机体对病毒的免疫应答不同,检测到的血液指标变化也不同[16]。白细胞主要参与机体的防御反应。HP-PRRSV感染早期(0~7 d)白细胞数目下降[17],是由于病毒感染后宿主免疫系统被抑制、淋巴细胞数目的减少所导致。本研究选取白细胞类的4种血液指标进行分析,其中白细胞计数、淋巴细胞百分比均在HP-PRRSV感染第4天降至最低值(表1),说明病毒感染第4天宿主的胸腺萎缩较严重,淋巴细胞凋亡情况较为严重;单核细胞计数在感染后第4天降低至最低值(表1),表明病毒感染早期,单核细胞从外周血迁移至组织分化为巨噬细胞,使得单核细胞数量减少,而后随着免疫系统的激活而逐渐恢复至正常值。粒细胞百分比在感染后第4天时达最高值,4~11 d逐渐降低(表1),表明PRRSV感染早期机体的炎症反应较为强烈。
3.2 HP-PRRSV感染后4种血液指标与抗病性的关系
机体对PRRS的抗病性具有品种差异[18]。笔者所在课题组前期研究发现HP-PRRSV感染后通城猪的白细胞数、淋巴细胞百分比均高于大白猪[14]。本研究以大白猪×通城猪高代横交群体为对象,根据存活力情况将其分为抗病组和易感组,分析发现抗病组和易感组的淋巴细胞百分比、粒细胞百分比均在感染第7天存在极显著差异(图1),且易感个体的淋巴细胞百分比极显著低于抗病个体,粒细胞百分比极显著高于抗病个体,这可能与易感个体在PRRSV感染后淋巴细胞凋亡和机体的炎症较严重有关。此外,易感组和抗病组的单核细胞数在感染前存在显著差异(图1C),表明不同个体单核细胞的分化程度不同,且抗病个体单核细胞的分化程度更高。
3.3 HP-PRRSV感染后4种血液指标与病毒载量的相关性
有研究表明小鼠的不同血液指标与H1N1感染的病毒载量存在不同程度的相关,其中白细胞计数与病毒载量存在弱相关,淋巴细胞百分比、单核细胞计数、粒细胞百分比与病毒载量均存在中度相关[19]。淋巴细胞在机体先天性和获得性免疫应答中均发挥着非常重要的作用,包括自然杀伤细胞(NK细胞)、T淋巴细胞和B淋巴细胞。PRRSV感染前期(0~7 d),病毒对机体天然免疫的抑制效应大于激活效应,淋巴细胞数目下降;后期机体主要通过T淋巴细胞介导的细胞免疫,以及其释放的细胞因子调节的其他免疫细胞的参与,来实现对病原的清除[1,20]。单核细胞通过血管壁从外周血迁移至不同组织分化为不同类型的巨噬细胞,主要通过吞噬和消化损伤或凋亡的细胞、细胞碎片,促进组织损伤的修复[21];粒细胞会迅速在肺部募集,完成对病毒的杀伤作用后凋亡,而凋亡后的粒细胞被巨噬细胞吞噬,并诱导抗炎症因子的释放,促进炎症反应消退,使机体恢复到正常[22]。病毒载量在感染第4天升至最高,第7天持续峰值,而后逐渐下降[15],本研究将白细胞计数、淋巴细胞百分比、单核细胞计数、粒细胞百分比与病毒载量进行相关分析,结果显示4种血液指标与病毒载量均存在中度相关,表明单个血液指标的影响有限,机体可能是通过多项血液指标的共同免疫应答来实现对病毒的清除。淋巴细胞百分比、粒细胞百分比与病毒载量存在较高的相关,易感组和抗病组的这2种血液指标在感染第7天均存在显著差异,抗病组的淋巴细胞百分比高于易感组、粒细胞百分比低于易感组,这些结果表明感染第7天淋巴细胞百分比、粒细胞百分比可以考虑作为PRRS抗病性的指示性状,但仍需要扩大群体进一步研究。
[1] HAN J,ZHOU L,GE X,et al. Pathogenesis and control of the Chinese highly pathogenic porcine reproductive and respiratory syndrome virus.[J]. Veterinary microbiology,2017,209:30-47.
[2] LAWSON S R,ROSSOW K D,COLLINS J E,et al. Porcine reproductive and respiratory syndrome virus infection of gnotobiotic pigs:sites of virus replication and co-localization with MAC-387 staining at 21 days post-infection[J]. Virus research,1997,51(2):105-113.
[3] ZHOU Y J,HAO X F,TIAN Z J,et al. Highly virulent porcine reproductive and respiratory syndrome virus emerged in China[J]. Transboundary and emerging diseases,2008,55(3/4):152-164.
[4] PARK J Y,KIM H S,SEO S H. Characterization of interaction between porcine reproductive and respiratory syndrome virus and porcine dendritic cells[J]. J Microbiol Biotechnol,2008,18(10):1709-1716.
[5] LUNNEY J K,FANG Y,LADINIG A,et al. Porcine reproductive and respiratory syndrome virus (PRRSV):pathogenesis and interaction with the immune system[J]. Annual review of animal biosciences,2016,4(1):129-154.
[6] LI Z,HE Y,XU X,et al. Pathological and immunological characteristics of piglets infected experimentally with a HP-PRRSV TJ strain[J/OL]. BMC veterinary research,2016,12(1):230 [2020-03-03]. https://pubmed.ncbi.nlm.nih.gov/27733150. DOI:10.1186/s12917-016-0854-x.
[7] RENSON P,ROSE N,DIMNA M L,et al. Dynamic changes in bronchoalveolar macrophages and cytokines during infection of pigs with a highly or low pathogenic genotype 1 PRRSV strain[J/OL]. Veterinary research,2017,48(1):15 [2020-03-03]. https://pubmed.ncbi.nlm.nih.gov/28241868. DOI:10.1186/s13567-017-0420-y.
[8] FERRARI L,CANELLI E,DE ANGELIS E,et al. A highly pathogenic porcine reproductive and respiratory syndrome virus type 1 (PRRSV-1) strongly modulates cellular innate and adaptive immune subsets upon experimental infection[J]. Veterinary microbiology,2018,216:85-92.
[9] ZHANG L,ZHOU L,GE X,et al. The Chinese highly pathogenic porcine reproductive and respiratory syndrome virus infection suppresses Th17 cells response in vivo[J]. Veterinary microbiology,2016,189:75-85.
[10] GINHOUX F,JUNG S. Monocytes and macrophages:developmental pathways and tissue homeostasis[J]. Nature reviews immunology,2014,14(6):392-404.
[11] KRATOFIL R M,KUBES P,DENISET J F. Monocyte conversion during inflammation and injury[J/OL]. Arteriosclerosis,thrombosis,and vascular biology,2017,37(1):35-42 [2020-03-03].https://pubmed.ncbi.nlm.nih.gov/27765768. DOI:10.1161/ATVBAHA.116.308198.
[12] NATHAN C. Neutrophils and immunity:challenges and opportunities[J]. Nature reviews immunology,2006,6(3):173-182.
[13] GEERING B,STOECKLE C,SÉBASTIEN C,et al. Living and dying for inflammation:neutrophils,eosinophils,basophils[J]. Trends in immunology,2013,34(8):398-409.
[14] LIANG W,LI Z,WANG P,et al. Differences of immune responses between Tongcheng (Chinese local breed) and Large White pigs after artificial infection with highly pathogenic porcine reproductive and respiratory syndrome virus[J]. Virus research,2016,215:84-93.
[15] 高国丽,孟向阁,官凯锋,等. HP-PRRSV人工感染后血清病毒载量和体重增长的变化规律[J].华中农业大学学报,2020,39(5):56-61.GAO G L,MENG X G,GUAN K F,et al. Changes of viremia and weight gain after HP-PRRSV artificial infection[J]. Journal of Huazhong Agricultural University,2020,39(5):56-61 ( in Chinese with English abstract ).
[16] CRYSTAL L,FERNANDO A,MICHAEL P,et al. Innate and adaptive immunity against porcine reproductive and respiratory syndrome virus[J].Veterinary immunology and immunopathology,2015,167(1/2) :1-14.
[17] KICKA R,AMARAL A F,CORTES L M,et al. The T-Cell response to type 2 porcine reproductive and respiratory syndrome virus (PRRSV)[J/OL]. Viruses,2019,11(9):796 [2020-03-03].https://pubmed.ncbi.nlm.nih.gov/31470568. DOI:10.3390/v11090796.
[18] 刘榜. 通城猪抗蓝耳病的遗传基础研究进展[J]. 现代牧业,2017,1(1):9-13.LIU B. Research progress on the genetic basis of Tongcheng pigs against PRRS[J].Modern animal husbandry,2017,1(1):9-13 ( in Chinese with English abstract ).
[19] MATTHIAS P,KLAUS S,ESTHER W,et al. Hematological parameters in the early phase of influenza A virus infection in differentially susceptible inbred mouse strains[J/OL]. BMC research notes,2015,8(1):225 [2020-03-03]. https://pubmed.ncbi.nlm.nih.gov/26047817. DOI:10.1186/s13104-015-1195-8.
[20] MICHAELC R,MICHAEL P M,LINDA D,et al. Mechanisms of adaptive immunity to porcine reproductive and respiratory syndrome virus[J/OL]. Viruses,2017,9(6):148 [2020-03-03]. https://pubmed.ncbi.nlm.nih.gov/28608816. DOI:10.3390/v9060148.
[21] GEISSMANN F,MANZ M G,JUNG S,et al. Development of monocytes,macrophages,and dendritic cells[J]. Science,2010,327(5966):656-661.
[22] MALLARYC G. Clearance of apoptotic neutrophils and resolution of inflammation[J]. Immunological reviews,2016,273(1):357-370.