近年来,我国雾霾天气频发,逐渐形成秋冬季常态化趋势[1]。雾霾天气不仅给人们出行带来诸多不便,还会增加患病(如呼吸道疾病)风险,对人体健康造成很大威胁[2]。研究表明,重污染期间二次无机气溶胶对雾霾的形成有重要贡献,其中硫酸盐作为大气细颗粒物PM2.5的主要成分(10%~20%),是二次气溶胶形成的主要驱动因素[3-5]。因此,厘清硫酸盐形成机制是解析大气雾霾形成的科学问题的关键。
硫酸盐气溶胶的形成主要涉及大气矿质颗粒物表面的非均相反应,该反应能够驱动大气中SO2在颗粒物表面发生吸附、迁移和转化等物理化学反应,从而影响大气中硫元素的汇和源过程[6-7]。进入大气中的矿质颗粒物随着来源不同,各自具有特殊的表面结构和独特的氧化还原性质,为SO2的非均相反应提供了丰富的反应位点,从而改变大气环境的内部组成和光学性质,造成雾霾天气的频繁发生[8-9]。因此,研究颗粒物参与的大气污染物SO2表面非均相反应对厘清硫酸盐气溶胶形成机制具有重要的科学意义。
本文综述了大气SO2污染物在矿质颗粒物表面非均相反应研究方面最新的进展,旨在厘清矿质颗粒物表面硫酸盐形成机制,为制定有效的雾霾控制策略提供理论依据。
1 大气中的矿质氧化物
矿质颗粒物是大气气溶胶的重要组成部分,它的活性表面参与了大气气相污染物SO2的迁移和转化,对硫酸盐气溶胶的形成起到了关键作用。据估算,全球每年约有10亿~30亿 t的矿物颗粒随强风进入大气中,其化学组成与大陆地壳相似,主要是Si、Al、Fe和Ca等元素的氧化物[10]。矿质氧化物的占比与其矿物尘埃的来源有关,大陆地壳中主要氧化物的丰度[11]由高到低依次如下:SiO2(61.5%)、Al2O3(15.1%)、Fe2O3(6.28%)、CaO(5.5%)、MgO(3.7%)、Na2O(3.2%)、K2O(2.4%)、TiO2(0.68%)、MnO(0.1%)、BaO(0.058 4%)。虽然SiO2占比很高,但是其化学活性较低[12]。此外,Al2O3、Fe2O3、CaO、MgO依次占有重要比例。其中,虽然TiO2作为原始矿质成分含量较低,但是随着新型纳米材料在各领域的大量使用,作为典型代表的TiO2纳米半导体材料也大量进入大气环境,继而形成了具有复杂组分的矿质颗粒气溶胶[11,13]。这些进入大气的矿质颗粒物可以根据光学活性大致分为具有光催化活性的纳米半导体颗粒物(例如TiO2和Fe2O3)和弱(无)光学活性的常规细颗粒物(例如Al2O3、MgO和CaO)。以下详细介绍了SO2在不同类型的矿质颗粒物表面发生的非均相反应。
2 SO2在矿质氧化表面的非均相反应
2.1 具有光化学活性的纳米半导体颗粒物
1)TiO2。典型半导体颗粒物TiO2进入大气环境中参与的SO2污染物迁移转化过程是研究大气硫循环的重要内容。研究表明,具有光催化活性的TiO2颗粒物能够利用太阳光催化氧化大气中的SO2[14-16]。Shang等[15]发现紫外光能够增强TiO2对SO2的吸收;相较于黑暗条件,其摄取系数提高了一个数量级。Ma等[16]利用原位红外光谱发现,在暗反应条件下SO2在TiO2表面非均相反应的主要产物是亚硫酸盐,光照能够促进其表面的亚硫酸盐转化硫酸盐。依据红外光谱中检测的硫物种,其团队提出TiO2表面上不饱和的Ti位点、暴露的低配位晶格氧位点和表面羟基是吸附SO2的主要活性位点,吸附的SO2能够在其表面形成化学吸附的亚硫酸盐。在光照条件下,TiO2受到光激发产生光电子和空穴。光电子能够被大气中的氧气分子捕获产生活性氧物种(·O2-),空穴能够氧化水蒸气产生·OH。生成的活性氧物种与含氧大气中的SO2或者表面吸附的亚硫酸盐进一步反应产生硫酸盐,从而促进大气中SO2转化为硫酸盐(图1)。
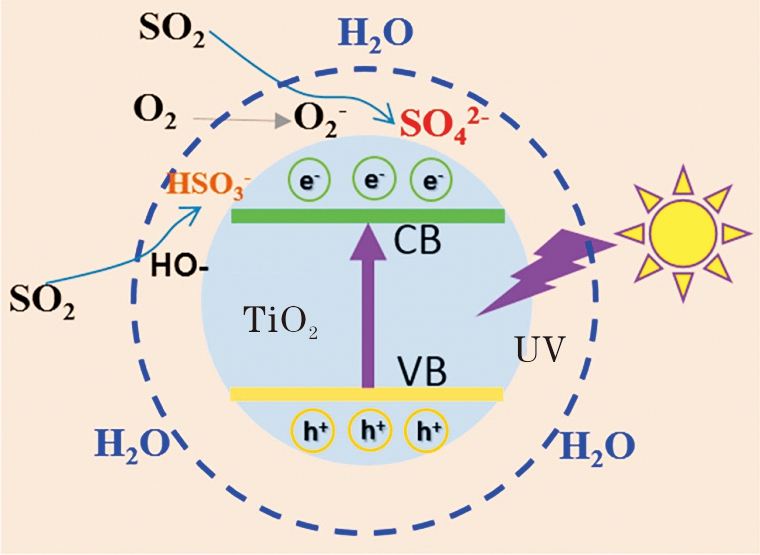
图1 SO2在TiO2表面非均相光化学反应机制[16]
Fig.1 The mechanism of heterogeneous photochemical reactions of SO2 on TiO2[16]
Nanayakkara等[17]利用红外光谱和同位素标记法进一步证明了TiO2表面羟基在SO2非均相反应中的重要作用。暗反应条件下,SO2不仅能够与一分子表面羟基(晶格氧)反应产生一分子吸附态的亚硫酸盐(式(1)~(2))[17],还能够与两分子表面羟基反应产生吸附态亚硫酸盐和一分子水(式(3)和图2)[17]。光照后表面亚硫酸盐会转化为硫酸盐(式(4)~(5))[17]。在高湿度的条件下,不同于硫酸盐能够稳定地吸附在TiO2颗粒物表面,表面吸附的亚硫酸与水分子形成SO2·H2O的水合物,继而在TiO2表面形成一层溶剂膜(式(6)~(9))[17]。
Ti-OH + SO2→ Ti-OSO2H
(1)
Ti-O2- + SO2→ Ti-SO32-
(2)
2Ti-OH + SO2→ Ti2-SO3·H2O
(3)
SO32- + O- → SO42- + e-
(4)
HSO3- + O- + OH- → SO42- + H2O + e-
(5)
Ti-O-SO2H + H2O  Ti-OH + SO2·H2O
Ti-OH + SO2·H2O
(6)
Ti2-O2SO·H2O + H2O  2Ti-OH + SO2·H2O
2Ti-OH + SO2·H2O
(7)
Ti-SO32- + H2O  Ti-O2 + SO2·H2O
Ti-O2 + SO2·H2O
(8)
HSO3-H+  SO2·H2O
SO2·H2O
(9)
TiO2作为高活性的光催化剂,许多研究表明它能够促进大气中氮氧化物(NOx)氧化生成硝酸盐。通常NOx是大气中与SO2共存的污染气体,能够参与SO2的大气化学过程,进而影响SO2在TiO2颗粒物表面的非均相反应机制。外场观测结果也验证了大气中矿质颗粒物表面的硫酸盐物种与硝酸盐的形成相关。Liu等[18]研究不同矿质颗粒物暗反应条件下NO2和SO2的协同作用时发现,NO2能够促进SO2在TiO2表面转化为硫酸盐,并且抑制亚硫酸盐的形成。这种复合型机制也适用于其他矿质氧化物颗粒,如Fe2O3、Al2O3、MgO和CaO等,后续将详细介绍。其他环境因素,诸如光照和湿度,对TiO2在NO2和SO2共存体系中的作用及相关机制仍需要进一步探究。
2)Fe2O3。Fe2O3是大气中常见的颗粒物,其在大气矿质颗粒物中的占比约为6.28%[11]。与其他氧化型颗粒物不同,它既有光化学活性,又有比较强的氧化性,能够通过铁循环实现SO2的氧化。因此,研究SO2在Fe2O3表面的非均相反应需要兼顾Fe元素价态的特异性。
Toledano等[19]通过测试光照对SO2在α-Fe2O3吸附、脱附动力学的影响,发现紫外光辐射α-Fe2O3显著增强了SO2的吸附速率。紫外光辐射产生的光载流子将体相Fe3+转化为Fe2+,而相对于Fe3+,Fe2+吸附SO2的能力更强。因此,紫外光辐射的α-Fe2O3表面能够化学吸附更多的SO2,其与表面O结合将产生更多SO32-或者SO42-。Li等[20]围绕铁矿物形态、反应条件(相对湿度和光照)进一步展开了SO2在Fe2O3表面非均相反应的研究,发现不同形态的Fe2O3矿物对SO2的吸收表现出显著差异。这可能是由于不同的来源和不同的形成过程使得Fe2O3矿物具有不同的比表面积和表面活性位点。通过对比4种不同形貌的α-Fe2O3吸收SO2的性能发现,六边形纳米片和颗粒状的α-Fe2O3具有较大的比表面积和丰富的表面活性位点。因此,其吸收SO2的能力高于胶囊状和空心的α-Fe2O3。红外光谱研究发现,暗反应条件下,除了SO2与表面吸附水反应生成溶液态的硫酸盐物种这种途径,SO2在Fe2O3表面的非均相反应主要涉及表面的配位不饱和的Fe原子、暴露的O原子和表面羟基。吸附态的SO2与晶格氧反应生成SO32-;表面吸附的O2能够被表面氧缺陷还原产生活性氧物种(O-、·O2-),继而氧化SO32-生成SO42-。另一方面,表面羟基也能够吸附SO2形成SO32-,之后被活性氧物种或者三价铁氧化为SO42-。不仅如此,反应过程中产生的自由基也能够促进三价铁与二价铁之间的循环,继而持续促进SO42-的形成。具体反应过程[20]见式(10)~(19):
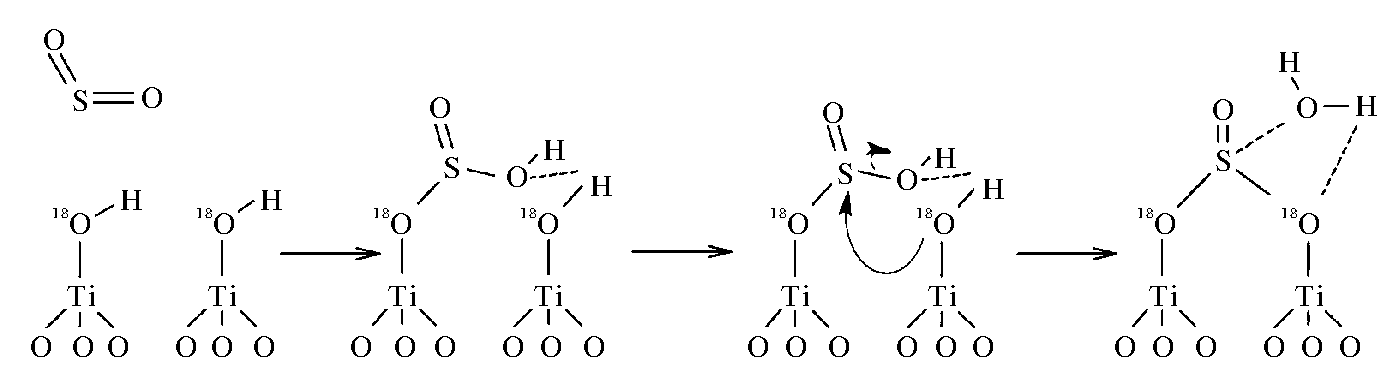
图2 SO2和表面羟基组形成吸附亚硫酸盐和水的反应[17]
Fig.2 Reaction of SO2 and surface hydroxyl groups to form adsorbed sulfite and water[17]
SO2 (g)  SO2 (ads)
SO2 (ads)
(10)
SO2 (g) + O2- (lattice) → SO32-
(11)
O (vacancy) + e- + O2→ O2- (ads)
(12)
O2- (ads) + e- → 2O-
(13)
SO32- + O- → SO42- + e-
(14)
 -Fe3+(OH) +
-Fe3+(OH) +  -H2O + SO2→
-H2O + SO2→  -Fe3+(OH) ·HSO3- + H+
-Fe3+(OH) ·HSO3- + H+
(15)
 -Fe3+(OH)·HSO3- →
-Fe3+(OH)·HSO3- →  -Fe3+OSO2- + H2O
-Fe3+OSO2- + H2O
(16)
2 -OH + SO2→
-OH + SO2→  -HSO3 + H2O
-HSO3 + H2O
(17)
 -HSO3 + O- →
-HSO3 + O- →  -HSO4- →
-HSO4- →  -SO42- + H+
-SO42- + H+
(18)
(19)
α-Fe2O3 + hv → e- + h+
(20)
e- + O2→ ·O2-
(21)
h+ + H2O → ·OH + H+
(22)
h+ + OH- → ·OH
(23)
·O2- + H+ → ·HO2
(24)
·OH/h+/·O2-/ ·HO2 + SO2/
SO32- → SO42- / HSO4-
(25)
通过对比光照条件,发现光辐射能够增强SO2的氧化反应。Fe2O3半导体催化剂(禁带宽约为2.2 eV)受光激发后产生的电子和空穴与表面吸附水(表面羟基)和吸附态的O2反应产生·OH、·O2-和·HO2。这些强氧化性的自由基继续参与SO2的氧化反应,进一步加速硫酸盐的形成(式(20)~(25))[20]。此外,环境中适度的水蒸气分子也能够促进SO2的氧化。当湿度适宜时,表面吸附的水分子不能完全覆盖Fe2O3表面的活性位点,SO2仍能够在表面活性位点处发生反应,并且表面吸附的水分子也有利于促进表面羟基的产生,继而增强SO2的氧化。但是若湿度过高,Fe2O3表面会形成一层水膜,将阻碍空气中的SO2与表面位点相接触,继而抑制SO2的非均相反应。除了具有代表性的α-Fe2O3颗粒物,Fu等[21]进一步对比了SO2在多种铁氧化物表面的非均相化学反应性能,发现SO2在不同铁氧化物表面形成的硫酸盐结构不同,α-Fe2O3、α-FeOOH和Fe3O4表面硫酸盐以双齿配位为主,γ-Fe2O3表面的硫酸盐以单齿为主,它们吸收SO2的能力排序为:α-Fe2O3>γ-Fe2O3>Fe3O4>β-FeOOH>α-FeOOH。崔虎雄等[22]研究表明:Fe2O3颗粒物表面SO2的非均相反应能够改变颗粒物的组成。对比反应前后的TEM图(图3),可以看出反应后α-Fe2O3颗粒物表层颜色变浅,这是由于表面产生的硫酸盐吸附到α-Fe2O3颗粒物表面导致的。反应生成的硫酸盐能够修饰α-Fe2O3颗粒物表面,使其由不规则的椭球形变得更加接近球形、更加光滑。这表明颗粒物表面非均相反应改变了颗粒物的形态、结构和粒径,继而对其光学特性和其相关的环境体系产生了较大影响。

图3 α-Fe2O3颗粒与SO2反应前(A,B)及反应后(C,D)的TEM图[22]
Fig.3 TEM images of α-Fe2O3 nanoparticles before (A,B) and after (C,D) exposure to SO2[22]
通常大气中SO2的非均相反应是一个复杂的多组分复合过程,它会涉及不同的污染物在颗粒物表面的吸附、迁移和转化行为。为了厘清多组分污染气体的复合效应,研究人员详细研究了典型污染物与SO2共存体系对SO2在Fe2O3表面的非均相反应的影响。Yang等[23]揭示了大气中NH3促进α-Fe2O3表面SO2非均相氧化反应的机制,发现NH3能够吸附在α-Fe2O3表面的路易斯酸位点、羟基和吸附水上,这增强了Fe2O3颗粒物表面的路易斯碱性,有利于吸附更多的SO2,继而实现表面SO2的快速转化和增强硫酸盐形成。反之,表面形成的硫酸盐进一步促进NH3的吸附,产生![]() 中和表面负电荷。此外,SO2与有机小分子污染物在Fe2O3表面的迁移和转化机制也被广泛研究。Wu等[24]探讨了大气中甲酸和SO2在α-Fe2O3表面非均相反应中的协同作用(图4)。当SO2与HCOOH共存时,HCOOH与SO2竞争Fe2O3表面的活性位点。由于SO2(pKa=1.90)酸性强于HCOOH(pKa=3.74),SO2更易于占据位点,转化为硫酸盐;HCOOH在Fe2O3表面的吸附则被抑制。当环境中SO2过量时,表面吸附的HCOO-离子会被SO2催化分解为CO2,进一步促进硫酸盐的累积。Zhao等[25]讨论了乙醛和SO2在α-Fe2O3表面的吸附行为。原位红外光谱结果表明,若SO2预先处理α-Fe2O3,其表面的乙醛氧化会被抑制;反之乙醛预吸附的α-Fe2O3催化氧化SO2(浓度228.8 mg/m3)的性能也会降低,而低浓度SO2(8.6 mg/m3)的氧化性能抑制效果不显著。并且SO2氧化产生的硫酸盐会增加α-Fe2O3的酸性,促进乙醛氧化产物质子化后以化学键形式吸附于α-Fe2O3表面。探究共存污染物气体对SO2在Fe2O3表面非均相反应的影响对于揭示真实大气中SO2的化学过程有深刻意义,目前涉及的协同/竞争机制仍需要进一步详细研究。
中和表面负电荷。此外,SO2与有机小分子污染物在Fe2O3表面的迁移和转化机制也被广泛研究。Wu等[24]探讨了大气中甲酸和SO2在α-Fe2O3表面非均相反应中的协同作用(图4)。当SO2与HCOOH共存时,HCOOH与SO2竞争Fe2O3表面的活性位点。由于SO2(pKa=1.90)酸性强于HCOOH(pKa=3.74),SO2更易于占据位点,转化为硫酸盐;HCOOH在Fe2O3表面的吸附则被抑制。当环境中SO2过量时,表面吸附的HCOO-离子会被SO2催化分解为CO2,进一步促进硫酸盐的累积。Zhao等[25]讨论了乙醛和SO2在α-Fe2O3表面的吸附行为。原位红外光谱结果表明,若SO2预先处理α-Fe2O3,其表面的乙醛氧化会被抑制;反之乙醛预吸附的α-Fe2O3催化氧化SO2(浓度228.8 mg/m3)的性能也会降低,而低浓度SO2(8.6 mg/m3)的氧化性能抑制效果不显著。并且SO2氧化产生的硫酸盐会增加α-Fe2O3的酸性,促进乙醛氧化产物质子化后以化学键形式吸附于α-Fe2O3表面。探究共存污染物气体对SO2在Fe2O3表面非均相反应的影响对于揭示真实大气中SO2的化学过程有深刻意义,目前涉及的协同/竞争机制仍需要进一步详细研究。
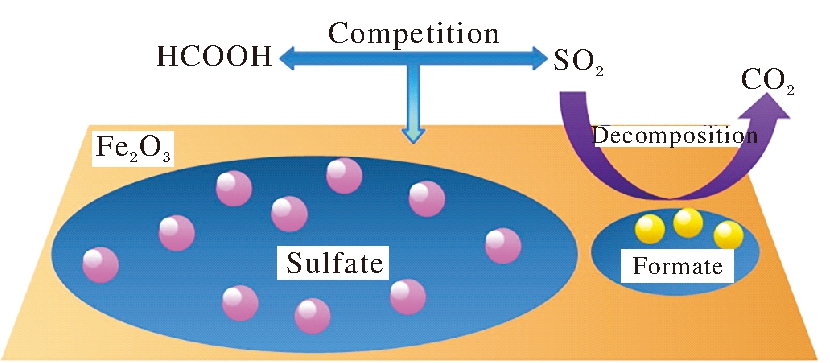
图4 α-Fe2O3表面SO2和HCOOH共吸附的机制[24]
Fig.4 Mechanism of the coadsorption of SO2 and
HCOOH on the surface of α-Fe2O3[24]
2.2 弱/无光化学活性矿质氧化物
不同于TiO2半导体颗粒物及Fe2O3这种具有光化学活性和氧化性的颗粒物在昼夜均会影响大气环境中SO2的化学变化,Al2O3、CaO和MgO等氧化型矿质颗粒物对SO2的表面非均相反应受到光照影响较小,主要是暗反应条件下表面配位不饱和的原子、晶格氧和表面羟基等活性位点上吸附SO2,生成亚硫酸盐,接下来亚硫酸盐会被空气中的氧气氧化生成硫酸盐[26]。
大气中硫酸盐和硝酸盐的形成过程通常与颗粒物参与的反应相关,NOx是研究SO2复合体系中常见的影响因素。Ullerstam等[27]强调NO2能够促进矿尘表面SO2非均相反应,但是其中涉及的复杂机制仍不清楚。Liu等[18]和Ma等[28]通过红外光谱实验继续证明了共存体系中NO2能促进矿质氧化物表面的亚硫酸盐转化为硫酸盐(图5)。同时,SO2能够改变硝酸盐的形成机制,表面吸附的NO2先转化为N2O4,再转化为NO3-。而N2O4作为氧化剂能够进一步促进亚硫酸盐向硫酸盐的转化。该体系中,Liu等[18]把污染物SO2和NO2浓度分别控制在572.0和410.7 mg/m3。之后,Ma等[29]把体系污染物SO2和NO2的浓度控制在2.90和0.41 mg/m3,提出了新的机制(图6)。通过实时监测NO2和SO2共存体系中MgO表面的非均相反应历程,其团队发现MgO表面有硫酸盐和新物种HONO的形成。红外光谱实验进一步证明表面形成的SO32-是NO2的吸附反应位点,其中NO2会进一步促进硫酸盐的累积。因此,他们推测在干燥条件下,NO2与MgO表面的SO32-反应产生NO2-和SO42-。而在潮湿条件下MgO表面吸附的H2O会进一步与NO2-反应形成HONO。之后,Wang等[30]结合原位红外光谱和DFT理论方法验证了上述HONO产生的路径。原位红外谱图表明SO2在MgO表面反应的主要产物是SO32-、HSO3-和SO42-;在体系中引入NO2和O2会促进表面SO32-转化为SO42-。DFT理论计算结果验证了红外图谱结果,发现在室温下O2需要克服0.67 eV的能垒才能氧化SO32-产生SO42-,而NO2则需要克服1.08 eV的能垒才能将SO32-转化为SO42-。只有NO2和O2共存才有利于SO32-转化为SO42-(能垒仅为0.16 eV)。不同于表面吸附的SO32-,SO2与表面羟基反应形成的HSO3-则能够被O2或者NO2氧化为SO42-。这2个反应都是热力学反应,其中NO2作为氧化剂氧化HSO3-或者SO32-时,可能会有HONO的产生。该反应机制与Liu等[18]和Ma等[28]提出的N2O4的中间产物机制不同,可能是因为两者的NO2起始浓度不同。低浓度条件下(NO2 0.41 mg/m3)可能更倾向于Ma等[29]提出的NO2-路径;高浓度条件下(NO2 410.7 mg/m3)则可能倾向于Liu等[18]和Ma等[28]提出的N2O4中间产物路径。

A:SO2和NO2单一组分的反应机制;B:SO2和NO2复合环境下的反应机制。A:Individual reaction of SO2 and NO2;B:Synergistic reaction between SO2 and NO2.
图5 SO2与NO2在矿质颗粒物表面协同反应机制(NO2 410.7 mg/m3)[18]
Fig.5 Reaction mechanism proposed for the synergistic reaction between SO2 and NO2 (NO2 410.7 mg/m3) [18]

图6 SO2与NO2共存体系中MgO表面的
非均相反应机制(NO2 0.41 mg/m3)[29]
Fig.6 Proposed reaction mechanism of NO2 adsorption
on MgO in the presence of SO2(NO2 0.41 mg/m3)[29]
2.3 真实矿质颗粒物
目前人们对于大气中矿质颗粒物中主要无机组分表面SO2非均相反应的历程已有了比较清楚的认识,而对于真实矿质颗粒物参与的反应历程仍知之甚少,这也是目前大气科学研究的难点和热点问题之一。Park等[31]利用美国亚利桑那测试粉尘(ATD)评估了SO2在其表面的非均相光化学反应动力学系数,发现紫外光照显著地增强了SO2在ATD表面的氧化性能。此外,水蒸气、O3和NO2也都能促进SO2的氧化。此现象与单一组分矿质氧化物表面SO2非均相反应的特征一致[18,31]。之后该团队比较了戈壁滩粉尘(GDD)与ATD对SO2的吸收性能,发现GDD颗粒物对SO2的吸收系数是ATD的2.0~2.5倍[32]。为了探究二者表面硫酸生成量不同的原因,该团队随后测定了2种颗粒物的元素组成、老化颗粒的酸度和吸湿性,发现导致2种颗粒物表面硫酸盐生成量不同的原因主要是其组分中半导体金属氧化物含量的不同和部分吸水性能的不同。紫外光照下,GDD和ATD内的半导体组分会被激发,经过光催化反应过程形成高活性的氧化物,如·OH、·HO2等自由基,这些自由基与SO2反应形成硫酸盐(图7)。因此,Park等[32]推导出矿质颗粒物的化学组分可能决定其SO2的吸收性能。此外,光照、湿度和共存NOx也会改变矿质颗粒物表面SO2的转化反应,这说明昼夜和环境的污染程度对大气中的SO2化学行为有着深远的影响。

图7 SO2在矿质颗粒物表面的非均相反应机制[32]
Fig.7 Reaction mechanisms for heterogeneous photooxidation
of SO2 on the surfaces of mineral dust particles[32]
为了更加真实地模拟大气环境中SO2的化学行为,研究者将实验室的微观机制研究与大气环境宏观观测有机地结合起来深入研究SO2的环境效应。He等[33]在烟雾箱中验证了矿质颗粒物和NOx对SO2成盐过程的促进作用,发现Al2O3颗粒物和NOx能提高硫酸盐的产量,而不加Al2O3的对照组中,NOx不会促进SO2转化为硫酸盐。并且他们采用2013年1月份北京地区重霾期间监测的数据进一步验证了该机制,发现重霾形成过程中PM2.5成分中硫酸盐的增长与矿质颗粒增长趋势一致,说明重霾期间矿质颗粒物是促进SO2成盐的关键因素。
3 讨论与展望
随着对雾霾形成机制愈加深入的研究,人们广泛认识到矿质颗粒物参与的SO2非均相反应对环境变化具有显著影响[34-36]。尽管矿质颗粒物对SO2成盐反应的影响十分复杂,但总体来看,矿质颗粒物在促进SO2转化为硫酸盐过程中起到了关键作用,其参与的化学变化导致大气中无机盐的浓度增加,进而加剧雾霾的形成。然而,在矿质颗粒物参与的SO2非均相反应的研究中,仍然还存在一些尚未清楚认识的问题,这些问题将是未来研究的重点内容。
1)矿质颗粒物表面的缺陷效应需要被重点关注。真实的大气颗粒物在成核过程会产生许多表面缺陷,尤其是以氧缺陷为代表的表面缺陷广泛地存在于矿质细颗粒表面。研究表明矿物颗粒的表面缺陷是活性氧物种(ROS、·O2-、·OH和O22-)的生成位点,ROS有利于驱动SO2的氧化转化[36-38]。因此,矿质颗粒物表面缺陷参与的大气污染物SO2表界面反应可能是影响大气中硫酸盐累积的重要因素之一,其中涉及的反应历程需要进一步研究。
2)矿质颗粒物表面非均相反应非常复杂。真实大气环境复杂,SO2的化学转化可能是多污染物共存条件下的复合污染过程[39],这些气体污染物或者其氧化产物(酸性盐)可能会改变矿质颗粒物表面的理化性质。因此,需要更多关注多组分在真实颗粒物表面的化学过程,并结合实际大气环境模拟污染物变化才更具有实际意义。
3)大气湿度及其导致的矿质颗粒物的吸湿现象对表面SO2非均相反应的影响仍需深入探讨。以往研究大多只是简单考虑了水蒸气对反应的影响或者是水分子吸附/脱附的物理过程,而其中的化学过程更值得深入研究。
4)缺失合理的大气污染物模型。目前的研究局限于单一微观机制研究或宏观观测,对于复杂的大气环境过程,需要将二者有机结合,从多个维度分析SO2在大气中的迁移和转化轨迹。将微观研究落地于宏观观测中,再反向推演出合理的大气污染物模型,弥补目前的模型理论缺失,为控制雾霾形成提供理论支持。
[1] LU K,FUCHS H,HOFZUMAHAUS A,et al. Fast photochemistry in winter time haze:consequences for pollution mitigation strategies[J].Environmental science & technology,2019,53(18):10676-10684.
[2] AN Z,HUANG R,ZHANG R,et al. Severe haze in northern China:a synergy of anthropogenic emissions and atmospheric processes[J].Proceedings of the National Academy of Sciences of the United States of America,2019,116(18):8657-8666.
[3] HUANG R J,ZHANG Y L,BOZZETTI C,et al. High secondary aerosol contribution to particulate pollution during haze events in China[J]. Nature,2014,514:218-222.
[4] GUO S,HU M,ZAMORA M L,et al. Elucidating severe urban haze formation in China[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014,111(49):17373-17378.
[5] XU W Q,SUN Y L,WANG Q Q,et al. Changes in aerosol chemistry from 2014 to 2016 in winter in Beijing:insights from high-resolution aerosol mass spectrometry[J]. Journal of geophysical research-atmospheres,2019,124(2):1132-1147.
[6] LI W J,SHAO L Y,ZHANG D Z,et al. A review of single aerosol particle studies in the atmosphere of East Asia:morphology,mixing state,source,and heterogeneous reactions[J]. Journal of cleaner production,2016,112(2):1330-1349.
[7] SULLIVAN R C,GUAZZOTTI S A,SODEMAN D A,et al. Direct observations of the atmospheric processing of Asian mineral dust[J]. Atmospheric chemistry & physics,2007,7(5):1213-1236.
[8] RAVISHANKARA A R. Heterogeneous and multiphase chemistry in the troposphere[J]. Science,1997,276(5315):1058-1065.
[9] ZHANG R Y,WANG G H,GUO S,et al. Formation of urban fine particulate matter[J]. Chemical reviews,2015,115(10):3803-3855.
[10] DENTENER F J,CARMICHAEL G R,ZHANG Y,et al. Role of mineral aerosol as a reactive surface in the global troposphere[J]. Journal of geophysical research-atmospheres,1996,101(D17):22869-22889.
[11] CHEN H,NANAYAKKARA C E,GRASSIAN V H. Titanium dioxide photocatalysis in atmospheric chemistry[J]. Chemical reviews,2012,112(11):5919-5948.
[12] USHER C R,AL-HOSNEY H,CARLOS-CUELLAR S,et al. A laboratory study of the heterogeneous uptake and oxidation of sulfur dioxide on mineral dust particles[J/OL]. Journal of geophysical research,2002,107(D23):4713[2020-04-29].https://doi.org/10.1029/2002JD002051,2002.
[13] RUBASINGHEGE G,ELZEY S,BALTRUSAITIS J,et al. Reactions on atmospheric dust particles:surface photochemistry and size-dependent nanoscale redox chemistry[J]. Journal of physical chemistry letters,2010,1(11):1729-1737.
[14] 王铃,马庆鑫,贺泓.光照对SO2在矿质氧化物表面非均相反应的影响[J]. 环境科学学报,2018,38(3):1155-1162. WANG L,MA Q X,HE H. Effect of UV light on the heterogeneous reaction of SO2 on different mineral oxide surfaces[J]. Acta scientiae circumstantiae,2018,38(3):1155-1162(in Chinese with English abstract).
[15] SHANG J,LI J,ZHU T. Heterogeneous reaction of SO2 on TiO2 particles[J]. Science China chemistry,2010,53(12):2637-2643.
[16] MA Q X,WANG L,CHU B W,et al. Contrary role of H2O and O2 in the kinetics of heterogeneous photochemical reactions of SO2 on TiO2[J]. The journal of physical chemistry A,2019,123(7):1311-1318.
[17] NANAYAKKARA C E,PETTIBONEAB J,GRASSIAN V H. Sulfur dioxide adsorption and photooxidation on isotopically-labeled titanium dioxide nanoparticle surfaces:roles of surface hydroxyl groups and adsorbed water in the formation and stability of adsorbed sulfite and sulfate[J]. Physical chemistry chemical physics,2012,14(19):6957-6966.
[18] LIU C,MA Q X,LIU Y C,et al. Synergistic reaction between SO2 and NO2 on mineral oxides:a potential formation pathway of sulfate aerosol[J]. Physical chemistry chemical physics,2012,14(5):1668-1676.
[19] TOLEDANO D S,HENRICH V E. Kinetics of SO2 adsorption on photoexcited α-Fe2O3[J]. The journal of physical chemistry B,2001,105(18):3872-3877.
[20] LI K J,KONG L D,ZHANZAKOVA A,et al. Heterogeneous conversion of SO2 on nano α-Fe2O3:the effect of morphology,light illumination and relative humidity[J]. Environmental science:nano,2019,6(6):1838-1851.
[21] FU H B,WANG X,WU H B,et al. Heterogeneous uptake and oxidation of SO2 on iron oxides[J]. The journal of physical chemistry C,2007,111(16):6077-6085.
[22] 崔虎雄,成天涛,陈建民,等. SO2在Fe2O3颗粒表面不同温度下非均相反应的实验模拟[J]. 物理化学学报,2008,24(12):2331-2336. CUI H X,CHENG T T,CHEN J M,et al. A simulated heterogeneous reaction of SO2 on the surface of hematite at different temperatures[J]. Acta physico-chimica sinica,2008,24(12):2331-2336(in Chinese with English abstract).
[23] YANG W W,MA Q X,LIU Y C,et al. The effect of water on the heterogeneous reactions of SO2 and NH3 on the surfaces of α-Fe2O3 and γ-Al2O3[J]. Environmental science:nano,2019,6(9):2749-2758.
[24] WU L Y,TONG S R,ZHOU L,et al. Synergistic effects between SO2 and HCOOH on α-Fe2O3[J]. The journal of physical chemistry A,2013,117(19):3972-3979.
[25] ZHAO X,KONG L D,SUN Z Y,et al. The interactions between heterogeneous uptake and adsorption of sulfur dioxide and acetaldehyde on hematite[J]. The journal of physical chemistry A,2015,119(17):4001-4008.
[26] ZHANG X Y,ZHUANG G S,CHEN J M,et al. Heterogeneous reactions of sulfur dioxide on typical mineral particles[J]. The journal of physical chemistry B,2006,110(25):12588-12596.
[27] ULLERSTAM M,JOHNSON M S,VOGT R,et al. DRIFTS and Knudsen cell study of the heterogeneous reactivity of SO2 and NO2 on mineral dust[J]. Atmospheric chemistry and physics,2003,3(6):2043-2051.
[28] MA Q X,LIU Y C,HE H. Synergistic effect between NO2 and SO2 in their adsorption and reaction on γ-alumina[J]. The journal of physical chemistry A,2008,112(29):6630-6635.
[29] MA Q X,WANG T,LIU C,et al. SO2 initiates the efficient conversion of NO2 to HONO on MgO surface[J]. Environmental science & technology,2017,51(7):3767-3775.
[30] WANG H H,ZHONG C,MA Q X,et al. The adsorption and oxidation of SO2 on MgO surface:experimental and DFT calculation studies[J]. Environmental science:nano,2020,7(4):1092-1101.
[31] PARK J Y,JANG M. Heterogeneous photooxidation of sulfur dioxide in the presence of airborne mineral dust particles[J]. RSC advances,2016,6:58617-58627.
[32] PARK J Y,JANG M,YU Z C. Heterogeneous photo-oxidation of SO2 in the presence of two different mineral dust particles:Gobi and Arizona dust[J]. Environmental science & technology,2017,51(17):9605-9613.
[33] HE H,WANG Y S,MA Q X,et al. Mineral dust and NOx promote the conversion of SO2 to sulfate in heavy pollution days[J/OL]. Scientific reports,2015,4:4172[2020-04-29]. https://doi.org/10.1038/srep04172.
[34] 马庆鑫,马金珠,楚碧武,等.矿质和黑碳颗粒物表面大气非均相反应研究进展[J]. 科学通报,2015,60(2):122-136. MA Q X,MA J Z,CHU B W,et al. Current progress towards the heterogeneous reactions on mineral dust and soot[J]. Chinese science bulletin,2015,60(2):122-136(in Chinese with English abstract).
[35] 马金珠,刘永春,马庆鑫,等.大气非均相反应及其环境效应[J]. 环境化学,2011,30(1):97-119. MA J Z,LIU Y C,MA Q X,et al. Atmospheric heterogeneous reactions and their environmental effects[J]. Environmental chemistry,2011,30(1):97-119(in Chinese with English abstract).
[36] GEORGE C,AMMANN M,D’ANNA B,et al. Heterogeneous photochemistry in the atmosphere[J]. Chemical reviews,2015,115(10):4218-4258.
[37] SETV N M,ASCHAUER U,SCHEIBER P,et al. Reaction of O2 with subsurface oxygen vacancies on TiO2 anatase (101)[J]. Science,2013,341(6149):988-991.
N M,ASCHAUER U,SCHEIBER P,et al. Reaction of O2 with subsurface oxygen vacancies on TiO2 anatase (101)[J]. Science,2013,341(6149):988-991.
[38] HE G,MA J,HE H. Role of carbonaceous aerosols in catalyzing sulfate formation[J]. ACS Catalysis,2018,8(5):3825-3832.
[39] 楚碧武,马庆鑫,段凤魁,等. 大气“霾化学”:概念提出和研究展望[J]. 化学进展,2020,32(1):1-4. CHU B W,MA Q X,DUAN F K,et al. Atmospheric “Haze Chemistry”:concept and research prospects[J]. Progress in chemistry,2020,32(1):1-4(in Chinese with English abstract).