流行性出血病病毒(epizootic haemorrhagic disease virus,EHDV)主要通过雌性库蠓(Culicoides)吸血叮咬反刍动物进行传播,并感染引起流行性出血病(epizootic haemorrhagic disease,EHD)[1]。EHD作为一种严重侵害反刍动物的非接触传染病,广泛流行于热带、亚热带等媒介昆虫活跃的地区,可感染牛[2]、鹿[3]、羊驼和部分山羊[4]等反刍动物,对鹿和牛的危害最为严重[2-4]。疫病的暴发给肉牛养殖业造成了严重的经济损失,扰乱了畜产品的正常国际贸易,2008年世界动物卫生组织(OIE)已将该病列为法定报告的跨境动物疫病[5]。
EHDV为呼肠孤病毒科(Reoviridae)环状病毒属(Orbivirus)成员,基因组由Seg-1至Seg-10的10个双链RNA节段构成,Seg-2编码的病毒外层衣壳蛋白VP2,是诱导寄主机体产生特异性中和抗体的主要蛋白,决定着EHDV的血清型[6-7]。EHDV的Seg-2/VP2具有高度变异的特性,不同血清型EHDV毒株之间Seg-2核酸序列的相似度在43.8%~70.1%,VP2氨基酸序列相似度在29.4%~72.2% [8]。值得注意的是,同一种血清型的不同地域毒株间Seg-2核酸序列的差异度可达29.5%,据此可将同一种血清型EHDV毒株进一步分为2种地域型,Eastern型与Western型 [9]。澳大利亚、日本和中国的EHDV分离株均属Eastern型,而分离自美洲、非洲、中东的EHDV毒株为Western型[10]。
目前世界范围已发现9种血清型的EHDV(EHDV-1、-2、-4、-5、-6、-7、-8、-9和-10)。EHDV的不同血清型毒株在世界各地区的流行存在较大差异:北美洲和南美洲主要流行有EHDV-1、-2、-6型[10];非洲主要流行有EHDV-1、-4、-6、-9型[4];澳大利亚流行有EHDV-1、-2、-5、-6、-7、-8型[11];地中海地区流行有EHDV-6与-7型[12],日本流行有EHDV-1、-2、-7与-10等4种血清型[13]。我国也同样存在多种血清型EHDV的流行,广西流行有EHDV-5、-6、-7、-8血清型[14],广东流行有EHDV-1与-5型[15],内蒙古存在EHDV-6型[16],云南省流行有EHDV-1、-2、-5、-6、-7、-10型[17]。随着近年来全球一体化进程的深入及全球气候变暖,EHD作为一种虫媒跨境传播疫病,在世界范围的活动范围正日趋扩大,导致的经济损失也在逐步增多。
由于不同血清型EHDV毒株间缺乏交叉免疫保护,在自然界中甚至存在一头动物被多种血清型EHDV感染的现象,给病毒的血清型鉴定和防控工作带来了极大的阻力[18],因此,快速准确鉴定本地区流行的EHDV毒株血清型具有重要意义。目前,国内尚无EHDV血清型特异性RT-PCR检测方法的报道,因此,根据我国流行的EHDV序列特征,建立快速准确的EHDV血清型诊断方法不仅是控制疫情的必要前提,也是制定动物免疫计划的基础。本研究报道了7种血清型EHDV(EHDV-1、-2、-5、-6、-7、-8、-10)特异性RT-PCR检测方法的建立以及在中国分离EHDV毒株血清型鉴定上的应用,旨在为我国开展EHDV的病原学诊断与流行病学调查提供有力保障。
1 材料与方法
1.1 毒株和质粒
研究中使用的31株分离自中国的EHDV毒株见表1,蓝舌病病毒(bluetongue virus,BTV),阿卡斑病病毒(akabane virus,AKAV)和中山病病毒(chuzan virus,CHUV)由笔者所在实验室保存。EHDV-2型毒株(AUS1979/01)与EHDV-8型毒株(AUS1982/06)源自澳大利亚麦克阿瑟-伊丽莎白(EMAI)研究所。EHDV Seg-5(基因节段5,编码NS1蛋白)全长克隆质粒PLB-EHDV-Seg5由笔者所在实验室构建保存。
表1 在中国分离的EHDV信息
Table 1 EHDV information isolated from China

病毒编号Number血清型Serotype分离日期Date分离地点Region经度Longitude纬度Latitude动物AnimalV128EHDV-12013/9/17V258EHDV-62016/8/23V260EHDV-62016/8/23V261EHDV-62016/8/23广东汕头Shantou,Guangdong E116°40N23°21′奶牛CowV259EHDV-62016/8/31V262EHDV-62016/8/31V263∗EHDV-62016/8/31V194∗EHDV-12016/6/11广西合浦Hepu,Guangxi E108°55′N21°29′黄牛CattleV195EHDV-12016/6/11V125EHDV-52013/6/27V126EHDV-52013/6/27广西马山Mashan,Guangxi E108°09′N23°42′水牛BuffaloV129EHDV-52013/7/4V127∗EHDV-52015/7/4广西融水Rongshui,Guangxi E109°15′N25°8′水牛BuffaloV023∗★EHDV-52013/9/16V024EHDV-52013/9/16云南德宏Dehong,Yunnan E98°31′N24°23′黄牛CattleV132∗EHDV-12014/7/29V271∗EHDV-52014/6/18V274∗EHDV-62014/7/24云南普洱Puer,Yunnan E101°51′N22°35′黄牛CattleV270∗EHDV-52014/8/13V278∗EHDV-72015/8/19V003∗★EHDV-62012/7/18V277∗EHDV-102013/6/12V269∗★EHDV-72013/8/13V083∗★EHDV-12014/8/12V273∗EHDV-62015/7/14云南师宗Shizong,Yunnan E104°17′N24°36′黄牛CattleV276∗EHDV-62015/8/25V281EHDV-12016/6/8V283EHDV-62016/6/15V282EHDV-102016/7/11V275EHDV-52016/10/18V280∗★EHDV-102017/7/11
注:*表示该毒株已经完成全基因组测序,★表示选择作为不同血清型EHDV的代表毒株进行RT-PCR特异性实验。Note:* represents that the whole genome of the strain has been sequenced,★represents that the strain was selected as a representative strain of different serotypes of EHDV for specific test.
1.2 主要试剂
MagMAXTM-96 Viral RNA Isolation Kit购自Ambion公司;Premix Ex Taq (Probe qPCR) Kit、One Step RT-PCR Kit、PrimeScriptⅡ逆转录酶、RNAse Inhibiter、dNTP(10 mmol/L)、Radom 6 mers随机引物(50 μmol/L)、EX Taq DNA聚合酶、SanPrep柱式DNA胶回收试剂盒、pMD19-T载体、E. coli DH5α感受态细胞和DL5000 Marker购自TaKaRa公司。
1.3 引物设计
从GenBank中下载不同血清型EHDV毒株Seg-2序列,使用MEGA 7.0软件与我们前期获取的15株中国分离EHDV-1、-5、-6、-7、-10型代表毒株(表1)的Seg-2全长序列进行序列比对。根据序列比对结果,选择不同血清型EHDV Seg-2的保守区域使用Primer Premier 6软件进行EHDV血清型特异性RT-PCR引物的设计(表2)。引物由武汉金开瑞生物有限公司合成,纯度为HAP级,用DEPC水溶解、稀释至终浓度为10 μmol/L。
表2 EHDV血清型RT-PCR扩增引物
Table 2 Different EHDV serotype-specific primer of RT-PCR

引物编号Primernumber血清型Serotype地域型Topotype引物名称Primername引物序列(5′-3′)Primer sequence(5′-3′)引物位置Position产物大小/bpAmpliconlengthP1EHDV-1WesternEHDV1-S2-FAACGGACAATCGTGGTGAGAG1 230~1 251EHDV1-S2-RGCATACAGCATAGCAACGGTAG2 378~2 4021 194P2EHDV-2EasternEHDV2-S2-FGGAGATACTATTTATAAATGGGA1 311~1 334EHDV2-S2-RGCCCTATTCACATTCTCATAG2 321~2 3421 052P5EHDV-5EasternEHDV5-S2-FAAGGAGACAACTTCGGAAGAGG1 369~1 390EHDV5-S2-RCCAGCGGAATCAAGTCTTCTAC2 342~2 363996P6EHDV-6EasternEHDV6-S2-FAGTTGCCCAAGAGTATGTGA1 229~1 249EHDV6-S2-RCATCATTCTGTAAAGATAGGTCG2 116~2 139913P7EHDV-7EasternEHDV7-S2-FAAGTGCGGAACATAAGAGATA1 051~1 036EHDV7-S2-RAAGAGTTTGTAGTACCTCATTCC2 180~2 2031 211P8EHDV-8EasternEHDV8-S2-FATATACGAGGAGTGAGTGGTGAG1 035~1 057EHDV8-S2-RTGCCATCAGGATCATTGAGACA2 074~2 0951 061P10EHDV-10EasternEHDV10-S2-FGGAGATACTATTTATAAATGGGA1 311~1 334EHDV10-S2-RGCCCTATTCACATTCTCATAG2 321~2 3421 052
1.4 病毒核酸提取及cDNA合成
使用病毒核酸提取试剂盒,按说明书操作提取EHDV-1、-2、-5、-6、-7、-8、-10代表毒株(表1)、BTV、AKAV、CHUV的病毒核酸。取5 μL提取的核酸为模板进行变性处理,使用PrimeScriptⅡ逆转录酶以20 μL反应体系进行cDNA的合成:5×PrimeScriptⅡ Buffer 4 μL,dNTP(10 mmol/L)1 μL,RNase Inhibitor(40 U/μL)0.5 μL,Radom 6 mers(50 μmol/L)1 μL,PrimeScriptⅡ RTase(200 U/μL)1 μL,变性RNA 5 μL,补水至20 μL。反应条件为:30 ℃ 10 min,45 ℃ 40 min,72 ℃ 10 min。
1.5 PCR反应体系的建立
使用表2中的EHDV血清型RT-PCR引物与对应的不同血清型EHDV代表毒株的cDNA进行PCR扩增,不同血清型反应体系均同时设立阴性对照。PCR反应体系为:cDNA模版1 μL,Ex Taq(5 U/μL)0.125 μL,10×Ex Taq Buffer 2.5 μL,dNTP Mixture(2.5 mmol/L)2.5 μL,上下游引物(10 μmol/L)各0.5 μL,加水补充至25 μL。反应条件为:94 ℃ 3 min; 94 ℃ 30 s,50 ℃ 30 s,72 ℃ 90 s,共30个循环;72 ℃ 5 min。取PCR产物以1.5%琼脂糖凝胶进行电泳检测,将符合扩增片段大小的PCR产物进行胶回收后,与T载体进行连接转化,筛选阳性菌落进行测序。
1.6 特异性试验
取合成的7种血清型EHDV(EHDV-1、-2、-5、-6、-7、-8、-10)、BTV、AKAV和CHUV的cDNA 1 μL为模板,使用表2中不同血清型引物,按建立的PCR反应体系进行PCR检测,不同血清型EHDV反应体系均同时设立阴性对照,取PCR产物进行电泳检测,分析EHDV血清型RT-PCR引物的特异性。
1.7 敏感性试验
以10倍梯度稀释的PLB-EHDV-Seg5质粒为标准品(拷贝数为:1.5×102~1.5×108 拷贝/μL)建立标准曲线,取1 μL不同血清型EHDV代表毒株cDNA为模板,采用绝对定量qPCR方法计算出不同血清型EHDV的cDNA拷贝数后将其进行10倍梯度稀释。取1 μL稀释后不同梯度的cDNA为模板,使用对应的血清型特异性引物进行PCR反应,不同血清型反应体系均设立阴性对照,确定该方法可检出的最低模板拷贝浓度,分析EHDV血清型RT-PCR引物的检测灵敏度。
1.8 中国分离EHDV毒株血清型的RT-PCR定型
取分离自我国云南省、广西壮族自治区与广东省的31株EHDV毒株病毒液各50 μL(表1)提取病毒核酸。取5 μL变性后的核酸为模板,使用EHDV群特异性引物和血清型特异性引物进行一步法RT-PCR反应,鉴定各毒株的血清型并同前期血清中和试验结果进行对比。将不同血清型阳性PCR产物送上海捷瑞公司进行测序,测序引物为EHDV各血清型RT-PCR引物。
使用DNASTAR软件对测序结果进行拼接,Mafft-win[19]软件进行序列的比对,MEGA 7.0[20]进行系统发生树的构建,建树选择的模型为:Neighbor-joining(邻近法),P-distance(遗传距离模式),Bootstrap(自举检验)取值1 000。系统发生树中其他国家分离的EHDV毒株序列以“GenBank序列号_病毒血清型_分离地点_分离时间”表示。
2 结果与分析
2.1 PCR反应体系的建议及产物鉴定
取不同血清型EHDV代表毒株(EHDV-1、-2、-5、-6、-7、-8和-10血清型毒株)cDNA为模板,用对应的血清型特异性引物进行PCR扩增,同时每种血清型均设立阴性对照。结果显示7种血清型EHDV Seg-2的扩增产物大小在800~1 200 bp,每种血清型阴性对照(N1~N10)均未出现非特异性扩增(图1)。对PCR产物进行T-A克隆的测序结果显示,所获得的节段均为EHDV的Seg-2基因片段:EHDV-1型代表毒株与分离自美国的Western毒株相似度最高(>85%),EHDV-2、-5、-6、-7与-10型代表毒株与分离自澳大利亚和日本的Eastern毒株相似度最高(>95%),表明设计的不同血清型RT-PCR引物可有效完成对应血清型毒株Seg-2片段的扩增。
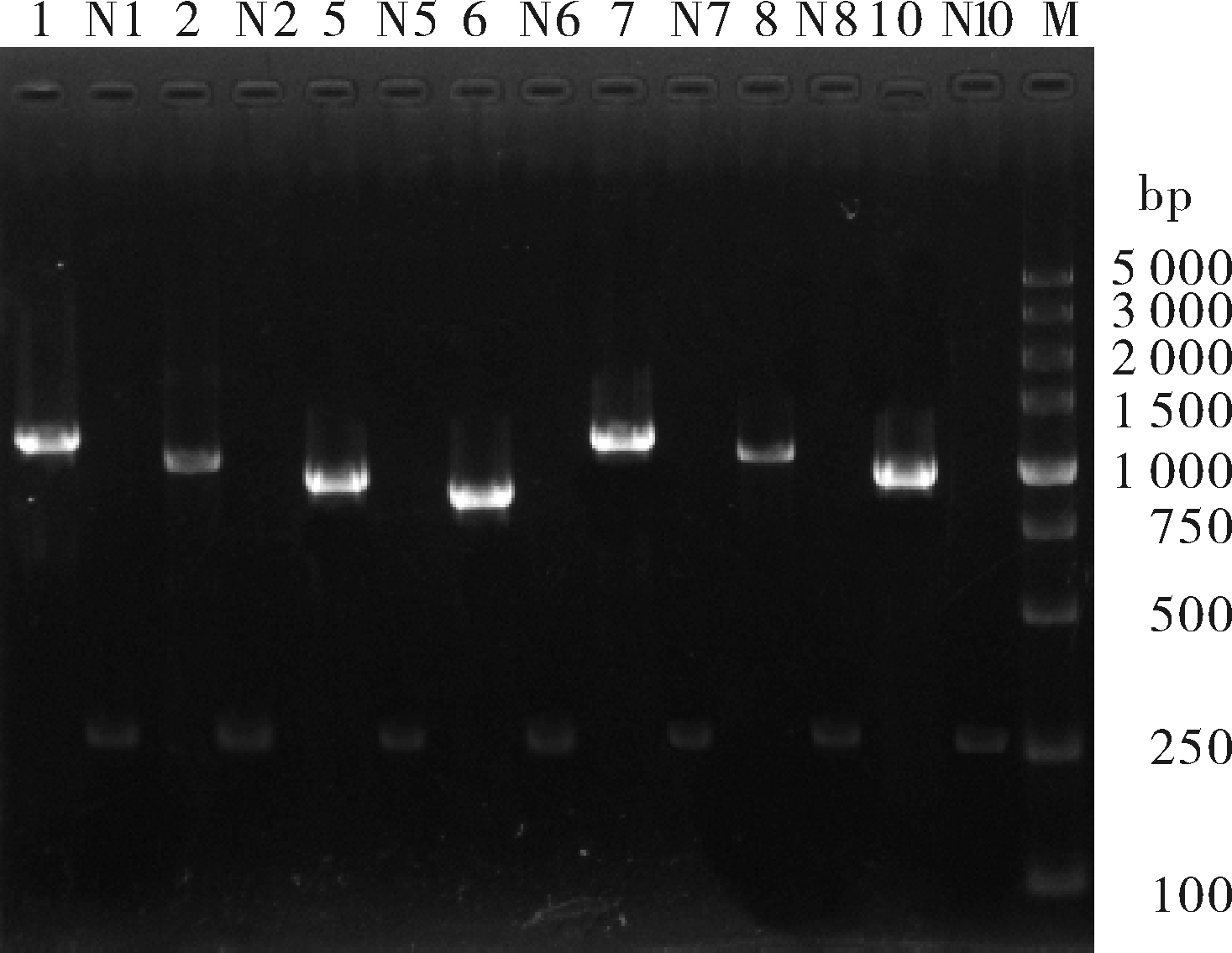
1:EHDV-1(YNSZ/V083/2014),2:EHDV-2(AUS1979/01),5:EHDV-5(YNMS/V023/2013). 6:EHDV-6 (YNSZ/V003/2012),7:EHDV-7(YNSZ/V269/2013),8:EHDV-8(AUS1982/06),10:EHDV-10 (YNSZ/V277/2013); N:阴性对照 Negative control; M:DL5000 DNA marker.
图1 不同血清型EHDV PCR检测结果
Fig.1 Detection of different serotypes of EHDV by PCR
2.2 特异性试验结果
以BTV、AKAV、CHUV和7种血清型EHDV(EHDV-1、-2、-5、-6、-7、-8和-10)的cDNA为模板,分别使用表2中不同血清型EHDV鉴定引物(P1~P10)进行PCR扩增,均设立阴性对照,分析引物的特异性。结果显示:EHDV血清型RT-PCR引物仅与对应血清型EHDV毒株的cDNA模板间有特异性的扩增条带产生,条带大小在800~1 000 bp,与其他血清型EHDV毒株,及相关病毒BTV、AKAV和CHUV之间及阴性对照无非特异性扩增产物出现(图2),表明EHDV血清型RT-PCR引物具有良好的特异性。

1、2、5、6、7、8、10:同图1 The same as Fig.1; B:蓝舌病毒株BTV; A:阿卡斑病病毒AKAV; C:中山病病毒 CHUV; N:阴性对照 Negative control; M:DNA分子质量标准DL5000 DNA marker.
图2 EHDV血清型引物特异性检测
Fig.2 The specificity assay of EHDV serotype primers
2.3 灵敏度试验结果
通过绝对定量qPCR计算出EHDV-1、EHDV-2、EHDV-5、EHDV-6、EHDV-7、EHDV-8和EHDV-10不同血清型EHDV代表毒株的cDNA拷贝数分别为1.1×109、1.4×1010、1.2×1011、3.6×1010、2.4×1010、8.7×108和2.1×109/μL。将上述cDNA进行10倍梯度连续稀释后,以对应的血清型特异性引物(P1~P10)进行PCR反应,分析EHDV血清型RT-PCR引物的灵敏度。结果显示EHDV-1、-2、-5、-6、-7、-8、-10血清型特异性RT-PCR引物对不同血清型EHDV核酸检测的最低拷贝数可达到为102 拷贝(图3),表明EHDV血清型RT-PCR引物具有良好的灵敏性。

1~10:病毒cDNA 101~1010倍稀释 The viral nucleic acid dilution was 101-1010; N:阴性对照 Negative control; M:DNA分子质量标准 DL5000 marker.
图3 EHDV血清型引物灵敏度检测
Fig.3 Sensitive detection of EHDV serotype primers
2.4 中国分离EHDV毒株的血清型RT-PCR鉴定结果
对分离自我国云南省、广西壮族自治区与广东省的31株EHDV毒株进行群特异性和血清型特异性一步法RT-PCR扩增,结果显示:31株EHDV分属EHDV-1、-5、-6、-7、-10等5种血清型,与前期中和试验鉴定的血清型结果吻合。将扩增的中国EHDV毒株Seg-2进行测序,构建的系统发育树(图4)显示,我国云南省、广东省与广西壮族自治区分离的31株EHDV分属EHDV-1、-5、-6、-7与-10等5种血清型,并以对应的血清型参考毒株聚为一簇,进一步表明血清型RT-PCR扩增的正确性。我国流行的EHDV-1型毒株的Seg-2属Western型,与分离自美国、尼日利亚的EHDV-1型毒株具有共同的起源,而我国流行的EHDV-5、-6、-7、-10型等毒株的Seg-2与分离自日本、澳大利亚的对应血清型毒株聚为一簇,均属Eastern型,有着最近的亲缘关系。
3 讨 论
EHDV的血清型主要由Seg-2编码的VP2决定,因此,Seg-2是EHDV血清型鉴定的首选靶基因。英国Pirbright实验室根据分离自非洲与中东地区的EHDV毒株Seg-2序列,初步建立了EHDV血清型特异性RT-PCR检测方法[21-22]。但是研究中我们发现Pirbright实验室开发的EHDV血清型RT-PCR引物对部分中国EHDV毒株无法扩增,或者扩增产物十分微弱,测序无信号产生。通过EHDV代表毒株的全基因组测序分析我们发现,Pirbright实验室公布的EHDV血清型RT-PCR引物与北美洲和中东的EHDV毒株的Seg-2序列具有较高的匹配度,但与中国不同血清型EHDV的Seg-2序列的匹配度较低,存在较多的碱基错配,这是导致引物对中国EHDV毒株无法扩增或者扩增效果较差的主要原因;此外,在日本和我国均发现EHDV-10型[23],目前尚无该血清型特异性RT-PCR鉴定方法的报道。因此,针对我国流行的EHDV血清型毒株Seg-2序列特征,设计引物和建立我国流行的EHDV毒株血清型鉴定RT-PCR方法十分必要。
目前血清中和试验是国际上血清检测的金标准,但该方法有操作要求高、检测时间长和必须获得血清型完整的标准毒株或血清等缺点,不利于EHDV血清型的快速鉴定。而病毒核酸的分子检测具有操作简便、检测样本量多、准确和快速等优点,已被广泛应用于各类疾病的快速诊断及血清型鉴定等方面。本研究以我国流行的5种血清型EHDV(EHDV-1、-5、-6、-7和-10)和澳大利亚的EHDV-2、EHDV-8型毒株的Seg-2序列为靶基因,设计血清型特异性RT-PCR检测引物用于EHDV的血清型检测。EHDV-4和EHDV-9型主要流行于非洲,目前世界范围仅报道过1株EHDV-4型毒株(NIG1968/01)在尼日利亚的分离[8],而EHDV-9毒株序列尚未在GenBank上公布任何序列信息,由于缺乏参考毒株,我们暂无法建立EHDV-4与EHDV-9型血清型RT-PCR的检测方法。

不同血清型EHDV参考毒株以▲表示,本研究中获取的序列以●表示。Reference strains of different serotypes of EHDV are expressed in triangles; virus sequences obtained in this study are represented by dots.
图4 基于NJ法的EHDV 参考毒株和中国毒株Seg-2序列的系统发育分析
Fig.4 Neighbor-joining tree,showing relationships in Seg-2 between reference and field strains of EHDV from China
本研究建立的EHDV血清型RT-PCR方法具有较好的特异性,在不同血清型EHDV间无交叉反应,与同样感染反刍动物的BTV、AKAV和CHUV等病毒之间也无交叉反应,可准确鉴定出EHDV-1、-2、-5、-6、-7、-8、-10等7种不同血清型的EHDV毒株。由于不同EHDV毒株在细胞上的增殖复制能力不同,导致分离EHDV毒株的病毒滴度及增殖特性差异明显,因此要求EHDV血清型RT-PCR方法应具备良好的灵敏度。灵敏度试验结果显示,本研究建立的方法对不同血清型EHDV核酸分子检测的最低下限均为102 拷贝,表明该血清型RT-PCR方法有较高的灵敏度。我国分离的31株EHDV毒株的血清型RT-PCR鉴定结果显示,这31株EHDV毒株分属EHDV-1、-5、-6、-7血清型,与前期病毒血清型鉴定的血清中和试验结果吻合,表明该方法可成功应用于我国流行的EHDV血清型鉴定。
建立EHDV血清型RT-PCR的另一个优势在于可以通过对扩增产物测序,进一步了解病毒Seg-2的遗传特性,从而分析病毒可能的来源以及病毒的活动规律,这将有助于更好地了解病毒的分布与流动情况。本研究中我们通过对中国EHDV毒株的测序发现:流行于我国云南、广东与广西EHDV-1的Seg-2均属于Western型,与美国毒株的亲缘关系最近, EHDV-5、-6、-7与-10型属于Eastern型,在遗传进化上与澳大利亚和日本毒株最接近,表明了我国EHDV起源上的多样性,因此,该EHDV RT-PCR方法具有较好的推广使用价值。下一步我们准备在EHDV血清型RT-PCR的基础上开发EHDV血清型荧光定量RT-PCR方法,进一步提高检测灵敏度和缩短鉴定时间,实现对临床血液样本中EHDV血清型的快速鉴定。
[1] SAVINI G,AFONSO A,MELLOR P,et al. Epizootic haemorrhagic disease[J]. Research in veterinary science,2011,91(1):1-17.
[2] YADIN H,BRENNER J,BUMBROV V,et al. Epizootic haemorrhagic disease virus type 7 infection in cattle in Israel[J]. Veterinary record,2008,162(2):53-56.
[3] MUTLU T E,KADIR Y,CARRIE B,et al. Epizootic hemorrhagic disease in cattle,western turkey[J]. Emerging infectious diseases,2009,15(2):317-319.
[4] MACLACHLAN N J,ZIENTARA S,SAVINI G,et al. Epizootic haemorrhagic disease[J]. Revue scientifique et technique-office international des epizooties,2015,34(2):341-349.
[5] CORBEL M J,MACMILLAN A P. Office international des epizooties OIE manual of standards for diagnostic tests and vaccines[M]. Paris:Office International Des Epizooties OIE,2014:422-432.
[6] MERTENS P P C,MAAN S,SAMUEL A,et al. Virus taxonomy eighth report of the international committee on taxonomy of viruses[M]. London:Elsevier/Academic Press,2005:466-483.
[7] ANBALAGAN S,COOPER E,KLUMPER P,et al. Whole genome analysis of epizootic hemorrhagic disease virus identified limited genome constellations and preferential reassortment[J]. Journal of general virology,2014,95(2):434-441.
[8] ANTHONY S J,MAAN S,MAAN N,et al. Genetic and phylogenetic analysis of the outer-coat proteins VP2 and VP5 of epizootic haemorrhagic disease virus (EHDV):comparison of genetic and serological data to characterise the ehdv serogroup[J]. Virus research,2009,145(2):200-210.
[9] ANTHONY S J,MAAN N,MAAN S,et al. Genetic and phylogenetic analysis of the core proteins VP1,VP3,VP4,VP6 and VP7 of epizootic haemorrhagic disease virus (EHDV)[J]. Virus research,2009,145(2):187-199.
[10] VIAROUGE C,LANCELOT R,RIVES G,et al. Identification of bluetongue virus and epizootic hemorrhagic disease virus serotypes in French Guiana in 2011 and 2012[J]. Veterinary microbiology,2014,174(1/2):78-85.
[11] OHASHI S,YOSHIDA K,YANASE T,et al. Analysis of intratypic variation evident in an Ibaraki virus strain and its epizootic hemorrhagic disease virus serogroup[J]. Journal of clinical microbiology,2002,40(10):3684-3688.
[12] WILSON W C,RUDER M G,KLEMENT E,et al. Genetic characterization of epizootic hemorrhagic disease virus strains isolated from cattle in Israel[J]. Journal of general virology,2015,96(6):1400-1410.
[13] OHASHI S.Identification and PCR-restriction fragment length polymorphism analysis of a variant of the Ibaraki virus from naturally infected cattle and aborted fetuses in Japan[J]. Journal of clinical microbiology,1999,37(12):3800-3803.
[14] 曹颖颖,吴健敏,林俊,等. 广西首例牛源鹿流行性出血热病毒的分离鉴定[J]. 中国预防兽医学报,2015,37(10):746-750.CAO Y Y,WU J M,LIN J,et al. Isolation and identification of the first case of epizootic hemorrhagic disease virus from cattle in Guangxi[J]. Chinese journal of preventive veterinary medicine,2015,37(10):746-750 (in Chinese with English abstract).
[15] 吕敏娜,朱建波,李娟,等. 广东一株牛源流行性出血病病毒的分离鉴定[J]. 中国预防兽医学报,2017,39(1):67-70.LYU M N,ZHU J B,LI J,et al. Isolation and identification of the epizootic hemorrhagic disease virus from cattle in Guangdong [J]. Chinese journal of preventive veterinary medicine,2017,39(1):67-70 (in Chinese with English abstract).
[16] 李占鸿,肖雷,杨振兴,等. 牛源流行性出血病病毒(EHDV)血清10型毒株在我国的分离鉴定[J]. 中国病毒学报,2019,35(1):112-120.LI Z H,XIAO L,YANG Z X,et al. Isolation and identification of the epidemic hemorrhagic fever virus serotype 10 strain from cattle in China[J]. Chinese journal of virology,2019,35(1):118-126 (in Chinese with English abstract).
[17] 杨振兴,孟锦昕,肖雷,等. 流行性出血病病毒(EHDV)血清7型毒株在中国的首次分离与鉴定[J].畜牧兽医学报,2019,50(3):602-610.YANG Z X,MENG J X,XIAO L,et al. Isolation of epizootic haemorrhagic disease virus serotype 7 strain in China for the first time[J]. Chinese journal of animal and veterinary,2019,50(3):602-610 (in Chinese with English abstract).
[18] VIAROUGE C,BREARD E,ZIENTARA S,et al. Duplex real-time RT-PCR assays for the detection and typing of epizootic haemorrhagic disease virus[J]. PLoS One,2015,10(7):1-11.
[19] KATOH K,ASIMENOS G,TOH H.Multiple alignment of DNA sequences with MAFFT[J]. Methods in molecular biology,2009,537(8):39-64.
[20] KOICHIRO T,GLEN S,DANIEL P,et al. MEGA6:molecular evolutionary genetics analysis version 6.0[J]. Molecular biology and evolution,2013,30(12):2725-2729.
[21] MAAN N S,SUSHILA M,KYRIAKI N,et al. RT-PCR Assays for seven serotypes of epizootic haemorrhagic disease virus & their use to type strains from the mediterranean region and North America[J/OL]. PLoS One,2010,5(9):e12782.https://doi.org/10.1371/journal.pone.0012782.
[22] SUN F,COCHRAN M,BECKHAM T,et al. Molecular typing of epizootic hemorrhagic disease virus serotypes by one-step multiplex RT-PCR[J]. Journal of wildlife diseases,2014,50(3):639-644.
[23] SHIRAFUJI H,KATO T,YAMAKAWA M,et al. Characterization of genome segments 2,3 and 6 of epizootic hemorrhagic disease virus strains isolated in Japan in 1985-2013:identification of their serotypes and geographical genetic types[J]. Infection,genetics and evolution,2017,53(12):38-46.